Introductie
Denk eens terug aan een belangrijke gebeurtenis in uw leven; iets dat grote indruk maakte. Kunt u zich herinneren hoe u zich toen voelde? Het is goed mogelijk dat u gestrest was. Misschien spanden uw spieren zich onbewust aan, ging uw hart tekeer en produceerde uw bijnierschors op volle kracht stresshormonen. Al uw energie en aandacht was waarschijnlijk gericht op die éne belangrijke gebeurtenis.
Deze totaalsom aan lichamelijke activiteit staat bekend als de ‘vecht- of vluchtreactie’. Die reactie wordt uitgelokt wanneer een gebeurtenis als ‘stressvol’ of ‘bedreigend’ wordt geïnterpreteerd (Sapolsky, 1998)21. Dit neurobiologische mechanisme speelt een essentiële rol in het faciliteren van onze stressreactie: vluchten, vechten en alles daartussenin.
Eén blik op de literatuur is al voldoende om te beseffen dat niet enkel ontzettend grote, maar ook normale, alledaagse, situaties of gebeurtenissen deze stressreactie kunnen uitlokken. Pijn (Vachon-Presseau et al., 2013)23, werkdruk (Eller, Netterstrom & Hansen, 2006)7, en stedelijke omgevingen (Lederbogen et al., 2011)12 zijn hier voorbeelden van. Alhoewel een acute stressreactie positieve effecten kan hebben in veel situaties (bijvoorbeeld een tijdelijke toename in aandacht of prestatie), weten we inmiddels dat intense en chronische stress gepaard gaan met (sub)klinische symptomen van psychiatrische ziektebeelden zoals depressie (Edwards et al., 2003)5 en psychose/schizofrenie (Read et al., 2005)20.
Samenvattend, stress is een dubbelzijdig zwaard. Aan de ene kant is het een essentieel onderdeel van ons alledaagse leven, aan de andere kant een potentiele bron van talloze ziektes. Alhoewel deze kennis voornamelijk is verkregen door epidemiologisch en gedragsmatig onderzoek zijn de hersenmechanismen rondom stress (acuut en chronisch) nog niet duidelijk vastgesteld. Nieuwe inzichten in de breinmechanismen achter de stressreactie biedt mogelijkheden voor interventies; zowel gedragsmatig als farmacologisch.
Dopamine, de prefrontale cortex en stress
Alhoewel de stressreactie ontzettend complex is en vele stofjes een rol spelen, heeft de neurotransmitter dopamine veel aandacht gekregen in de context van stress (Mizrahi et al., 2012; Pruessner et al., 2004; Walker & Diforio, 1997)141925. De ‘grondstof’ voor dopamine wordt verkregen vanuit tyrosine, wat in voedsel zit. In het brein bindt dopamine aan verschillen receptoren (subtype D1 tot en met D5) en zo speelt het een belangrijke rol in onder andere beweging, cognitieve prestatie en beloningsprocessen (Egerton et al., 2009)6.
Dierwetenschappelijk onderzoek heeft consistent aangetoond dat dopamineniveaus in frontale delen van het brein toenemen na blootstelling aan kortdurende stress. Echter, langdurige blootstelling aan stress dempt dopamine niveaus in deze gebieden. Tegelijkertijd lokt langdurige stress een hypergevoeligheid uit in het striatum, een subcorticaal hersengebied met een hoge dichtheid van cellen die dopamine afgeven (Pani, Porcella & Gessa, 2000)18. Kortom, langdurige stress brengt een disbalans teweeg in het brein. Interessant genoeg vertoont het gedrag van zulke langdurig gestreste dieren gelijkenissen met symptomen van angst- en stemmingsstoornissen (Pani et al., 2000).
Er kan dus worden gesteld dat dopaminerge cellen in frontale delen van het brein (deel van het mesocorticale dopaminepad) de stressverwerking lijken te reguleren. Treden er veranderingen op in dit regulerend vermogen, bijvoorbeeld door overmatige blootstelling aan stress, dan heeft dit negatieve consequenties voor stressverwerking en vinden er waarneembare gedragsveranderingen plaats. Veranderingen in het mesocorticale dopaminepad kunnen daarom mogelijk het verband tussen chronische stress en (kwetsbaarheid voor) sommige psychiatrische ziektebeelden verklaren.
Alhoewel de rol van het mesocorticale pad in stressverwerking is vastgesteld in dieren, blijft dit in mensen nog een assumptie. Gelukkig is het door recente ontwikkelingen op gebied van medische beeldvorming mogelijk geworden om dit soort hypothesen te toetsen zonder het brein binnen te dringen. Zoals verderop uitgebreid beschreven in de methodensectie, onderzochten wij in een drietal studies hoe acute en langdurige stress dopamineniveaus in het mesocorticale pad beïnvloedden, met bijzondere interesse voor de prefrontale cortex.
Onze eerste hypothese betrof acute stress: gebaseerd op dieronderzoek verwachtten wij een negatief verband tussen prefrontale dopamine-niveaus tijdens een acute stresstaak en de stressgevoeligheid van die persoon. Met andere woorden, hoe lager prefrontale dopamineniveaus tijdens de stresstaak, hoe stressgevoeliger de persoon is. Met betrekking tot chronische stress voorspelden wij dat een hoge cumulatieve blootstelling aan stress was geassocieerd met lagere prefrontale dopamineniveaus tijdens de stresstaak én een hogere stressgevoeligheid. Oftewel, langdurige stress vermindert het vermogen om met nieuwe stressoren om te gaan en maakt zo mensen gevoelig voor psychische klachten. De hypotheses rondom acute stress werden getoetst in een niet-klinische steekproef; hypotheses rondom chronische stress in zowel een klinische (psychose) als niet-klinische steekproef.
Methode
Stress-inductie
In de drie studies, die hieronder worden uitgelegd, was het gebruik van een experimentele stresstaak essentieel. Kortdurende stress werd uitgelokt door middel van de Montreal Imaging Stress Task (mist). Tijdens deze gevalideerde taak losten deelnemers wiskundige sommen in rap tempo op. De uitkomst van deze sommen was altijd te herleiden tot een ééncijferig getal (voorbeeld: 54/9-4). Stress werd geïnduceerd door middel van drie manipulaties: 1) onvoldoende tijd om sommen op te lossen in een kwart van de opgaven, 2) een geluid met hoge frequentie dat werd afgespeeld tijdens het oplossen van de som en 3) gestandaardiseerde negatieve feedback gericht op de geleverde prestatie.
Zowel een stress- als controleversie van de mist werden afgenomen. Beide versies duurden zeventig minuten, waarin alle deelnemers tien maal vijf minuten lang sommen oplosten. Tijdens beide versies werd subjectieve stress gemeten door drie stellingen: ‘Ik voel mij ontspannen’, ‘Ik voel mij beoordeeld’ en ‘Ik voldoe niet aan de verwachtingen’ (Cronbach’s α=0.69). Deze items werden beantwoord op een zevenpuntschaal (1=helemaal niet, 7=heel erg).
Eerder werk van onze onderzoeksgroep heeft laten zien dat dit experiment concentraties van het stresshormoon cortisol en de ervaring van stress (subjectieve stress) verhoogt (Lataster et al., 2011)11. Na afloop van het experiment daalden cortisolniveaus en subjectieve stress weer tot baseline niveaus.
Dopamineniveaus gemeten met pet
Corticale dopamineniveaus werden gemeten tijdens een drie uur durende positron emissie tomografie (pet)-scan, waarin de stress- en controleversie van de mist werden afgenomen (Lataster et al., 2011). pet is een gevalideerde beeldvormingsmethode die neurotransmitterniveaus in kaart brengt. Tijdens een pet-onderzoek wordt een radioactief isotoop intraveneus toegediend aan de deelnemer. Dit radioactieve isotoop (bijvoorbeeld koolstof-11 of fluor-18) is gekoppeld aan een molecuul dat bijzonder veel lijkt op de neurotransmitter die men beoogt te bestuderen, in ons geval dopamine. De combinatie van dit isotoop en het molecuul heet een radioactieve tracer. Wanneer de radioactieve tracer is toegediend, bindt die op plekken waar veel dopamine te vinden is. Als er op een plek veel tracerbinding wordt gemeten, dan betekent dit dat er weinig dopamine aanwezig is (en vice versa).
Wij vergeleken tracerbinding tussen de stress en de controleconditie van de mist. Zo konden wij meten hoeveel dopamine er vrijkwam tijdens acute stress, vergeleken met een stressloze controleconditie. Voor de doeleinden van dit onderzoek kozen wij als radioactieve tracer 18-fluor fallypride (18F-fallypride; Lataster et al., 2011; Mukherjee et al., 2002)15, een radioactieve tracer met zeer hoge affiniteit voor dopamine D2/3 receptoren.
Experimenten één en twee: acute stress en het dopaminesysteem
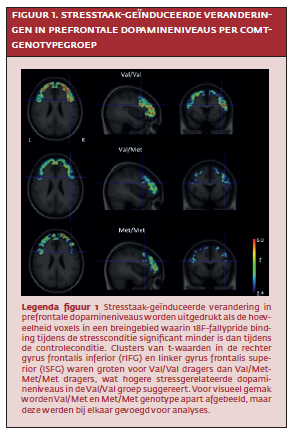
Hypotheses rondom acute stress werden getoetst in twee experimenten. In experiment één verzamelden wij data van 26 mensen zonder dsm-iv-diagnose van een psychiatrische stoornis zoals depressie of schizofrenie. De groep werd ingedeeld op basis van catecholo- methyl-transferase (comt) genotype. COMT is een enzym dat dopamineniveaus in de cortex reguleert (Mannisto & Kaakkola, 1999)13. Natuurlijke variatie in dit gen (Val/Val, Val/Met of Met/Met variant) bepaalt mede de hoeveelheid extracellulaire dopamine in corticale gebieden. De verdeling van comt-genotype was: acht Val/Val, veertien Val/Met en vier Met/Met dragers. Conform eerder werk werden Val/Met en Met/Met-dragers bij elkaar gevoegd (Walder et al., 2010)24.
Alle deelnemers werden blootgesteld aan de stresstaak terwijl dopamineniveaus en subjectieve stress werden gemeten. De rationale achter dit experiment was dat variatie in comt-genotype prefrontale dopamine niveaus tijdens de stresstaak en dus stressgevoeligheid zou beïnvloeden.
Van experiment één deden 25 deelnemers mee aan een tweede follow-up experiment. Tijdens een gestructureerde dagboekstudie maten wij stressgevoeligheid in het dagelijks leven. Stressgevoeligheid werd gedurende zeven dagen tien keer per dag op willekeurige momenten gemeten tussen acht uur ‘s ochtends en elf uur ’s avonds. Onze maat van stressgevoeligheid was gericht op stress rondom dagelijkse activiteiten en werd gemeten met de volgende items: ‘Ik kan dit goed’, ‘Dit kost mij moeite’ en ‘Ik doe liever iets anders’ (een acceptabele α van .52; Myin-Germeys et al., 2005)16.
Op dezelfde meetmomenten werden subklinische psychische klachten ook gemeten. Deze items maten subklinische psychotische symptomen: ‘Ik voel mij achterdochtig’, ‘Ik voel mij onwerkelijk’, ‘Ik voel dat andere mensen mij niet mogen’, ‘Ik voel dat andere mensen mij iets willen aandoen’, ‘Mijn gedachten worden door anderen beïnvloed’, ‘Ik ben bang om de controle te verliezen’, ‘Mijn gedachten laten mij niet los’, ‘Ik hoor stemmen’ en ‘Ik zie dingen die er niet echt zijn’ (α=.8; Myin-Germeys et al., 2005). De keuze voor psychose-items was gebaseerd op de kennis dat stress een risicofactor is voor psychose (Read et al., 2005). Daarnaast gaat psychose(gevoeligheid) gepaard met veranderingen in het dopaminesysteem én een toename in stressgevoeligheid (Walker & Diforio, 1997). Stellingen werden in een papieren boekje opnieuw beantwoord op een zevenpuntsschaal. Het willekeurige signaal om het boekje in te vullen werd uitgezonden door een horloge.
We verwachtten een verband tussen stressgevoeligheid in het dagelijks leven en prefrontale dopamineniveaus tijdens de stresstaak in het laboratorium. Specifieker: mensen met lagere prefrontale dopamineniveaus tijdens de taak ervaren sneller psychische klachten in reactie op de omgeving dan mensen met hogere prefrontale dopamineniveaus tijdens de taak. In dit tweede experiment werd niet gekeken naar het comt-genotype; er bestonden geen subgroepen.
Experiment drie: langdurige stress en het dopaminesysteem
In een laatste experiment werd de relatie tussen cumulatieve blootstelling aan stress en prefrontale dopamineniveaus tijdens de stresstaak onderzocht. Data van twaalf gezonde vrijwilligers zonder diagnose van een psychiatrische stoornis werden verzameld; zij deden niet mee aan experiment één/twee. Daarnaast namen twaalf medicatievrije vrijwilligers met een diagnose van een psychotische stoornis deel.
De reden om een klinische en controlegroep met elkaar te vergelijken is dat stress psychische klachten kan veroorzaken, met name psychotische klachten. Daarnaast bestaat er binnen psychose en schizofrenie indirect bewijs voor ‘dopaminerge hypofrontaliteit’ (Howes & Kapur, 2009)9. Dat wil zeggen; een afname in corticale, vooral prefrontale, dopamineniveaus.
Eerst werd blootstelling aan stress vroeg in het leven (tot negentien jaar) gemeten. Dit werd gedaan met de ‘Childhood Experience of Care and Abuse’ (ceca), een valide en betrouwbare vragenlijst om intense en traumatische gebeurtenissen zoals misbruik, mishandeling en verwaarlozing te meten (Bifulco et al., 2005)1. Een cumulatieve score van alle vijftien ja-nee items werd als uitkomstmaat gehanteerd (‘nee’ = 0, ‘ja’ = 1). Een voorbeelditem: ‘Werden uw basisbehoeften ooit verwaarloosd?’ Daarna ondergingen deelnemers de stresstaak terwijl corticale dopamineniveaus en subjectieve stress werden gemeten. Onze verwachting was dat méér stress vroeg in het leven was geassocieerd met lagere prefrontale dopamineniveaus én hogere subjectieve stress tijdens de stresstaak. Ook verwachtten wij dat deze associatie sterker zou zijn in de groep van mensen met een diagnose van een psychotische stoornis, wat zou suggereren dat zij sensitiever zijn voor stress.
Statistische analyses
Stresstaak-gerelateerde corticale dopamineniveaus werden gekwantificeerd als de geschatte verandering in tracerbinding tussen stress en controleconditie van de mist. Ventrale en, waar mogelijk, dorsale prefrontale hersengebieden werden onderzocht. Subjectieve stress werd gekwantificeerd als het verschil in subjectieve stress tussen stress en controleconditie van de mist.
In experiment één onderzochten wij of stressgerelateerde prefrontale dopamineniveaus en subjectieve stress verschilden per comt-genotypegroep. In twee aparte lineaire regressieanalyses diende comt-genotypegroep als onafhankelijke variabele en stresstaak-gerelateerde prefrontale dopamineniveaus (analyse 1) en subjectieve stress (analyse 2) als afhankelijke variabelen.
In experiment twee werd een logistische multilevel regressieanalyse toegepast om de associatie tussen stressgerelateerde prefrontale dopamineniveaus en stressgevoeligheid in het dagelijks leven te onderzoeken. Een multilevel analyse was essentieel omdat dagelijks leven-data meerdere meetmomenten bevatten (maximaal tien momenten per dag). Er moet daarom gecorrigeerd worden voor het feit dat metingen binnen personen meer op elkaar lijken dan metingen tussen personen (Schwartz & Stone, 1998)22. Een reguliere (single level) regressieanalyse houdt geen rekening met meerdere niveaus. Een interactiemodel werd gehanteerd met stressgerelateerde prefrontale dopamineniveaus en een gesommeerde score van stress in het dagelijks leven als onafhankelijke variabelen. De afhankelijke variabele was een categorische indeling (0=‘nee’, 1=‘ja’) van psychische klachten in het dagelijks leven. Zowel in experiment één als twee werden geslacht en leeftijd als covariaat geïncludeerd.
In experiment drie diende de gesommeerde score op de ceca als maat van cumulatieve stress en onafhankelijke variabele. In twee verschillende analyses dienden stressgerelateerde prefrontale dopamineniveaus en subjectieve stress als afhankelijke variabelen. Er werd ook een interactieanalyse getoetst tussen ceca-score en groep (controle of psychose) getoetst.
Alle analyses van experiment drie waren ANOVA’s. Omdat de groepen waren gematcht op geslacht en leeftijd werd er in experiment drie niet gecontroleerd voor deze factoren. Door middel van Bonferroni-correctie (Bland & Altman, 1995)2 werd er gecorrigeerd voor meerdere vergelijkingen: de alphawaarde (drempelwaarde) werd gedeeld door het aantal toetsen, om zo vals-positieve bevindingen zoveel mogelijk uit te sluiten.
Resultaten
Steekproefbeschrijving
In experiment één/twee bedroeg de gemiddelde leeftijd 40.42 jaar (sd=14.82). De geslachtsverdeling was vijftien mannen en elf vrouwen. In experiment één was de verdeling van geslacht, leeftijd en opleidingsniveau eerlijk verdeeld over comt-genotypegroepen. In experiment drie bedroeg de gemiddelde leeftijd 48.08 jaar (sd=9.94) voor controledeelnemers en 44.67 jaar (sd=11.24) voor mensen met een psychotische stoornis. In beide groepen was de geslachtsverdeling acht mannen en vier vrouwen. Er waren geen verschillen in leeftijd, geslacht en opleidingsniveau tussen groepen. Deelnemers met een psychotische stoornis waren gemiddeld 7.09 jaar (sd=4.96) medicatievrij en namen geen stemmingsstabilisatoren of dopaminerge medicatie ten tijde van de scan. Drugsgebruik en zwangerschap werden op de dag van de scan uitgesloten door een urinescreening. Door middel van een telefonische screening werd drugsgebruik in het verleden uitgesloten (voor zover dit mogelijk is).
Bevindingen experiment één
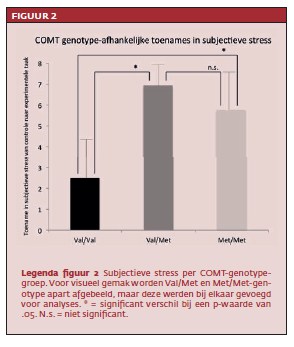
Vergeleken met de controleconditie nam subjectieve stress in de hele steekproef toe tijdens de stressconditie (T=7.98, p<.01). Stress-gerelateerde prefrontale dopamineniveaus waren hoger in de Val/Valgroep dan de gecombineerde Val/Met-Met/Met-groep. Dit werd geobserveerd in de rechter gyrus frontalis inferior (T=- 4.24 , p<.01) en linker gyrus frontalis superior (T=-3.4, p=<.01; zie figuur 1). Er was ook een effect van comt-genotype op subjectieve stress: de Val/Val-groep ervoer tijdens de taak minder stress dan de gecombineerde Val/Met-Met/Metgroep (T=2.33, p=.02; zie figuur 2).
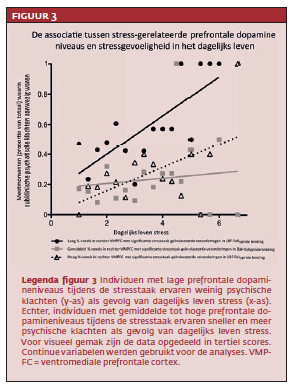
Bevindingen experiment twee In de dagelijks leven-studie waren er voor vrouwen (M=55, sd=2.6) meer meetmomenten dan voor mannen (M=46, sd=9.35; Z=-9.34, p=.01). Er was een verband tussen stressgerelateerde dopamineniveaus in de rechter ventromediale prefrontale cortex (vmpFc) en stressgevoeligheid in het dagelijks leven (Z=-2.2, p = .03). Dezelfde niet-signifi cante trend werd geobserveerd in de linker vmpFc (Z=-1.88, p=.06). Deze resultaten tonen aan dat mensen met lage stressgerelateerde ventromediale dopamineniveaus sneller en met meer subklinische psychotische symptomen reageren op stress in het dagelijks leven dan mensen met hogere stressgerelateerde ventromediale dopamineniveaus (zie figuur 3).Bevindingen experiment drie Vergeleken met de controleconditie nam ook in experiment drie subjectieve stress in de hele steekproef toe tijdens de stressconditie (Z=6.07; p<.01). Er was geen verschil tussen controledeelnemers en mensen met een psychotische stoornis (Z=−1.14, p=.26). De hoeveelheid cumulatieve stress gemeten met de ceca was gelijk voor controledeelnemers (M=2.42, sd=1.51) en deelnemers met een psychotische stoornis (M=3.42, sd=1.88; T=-1.31, p=.2)
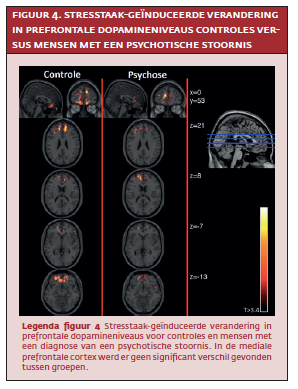
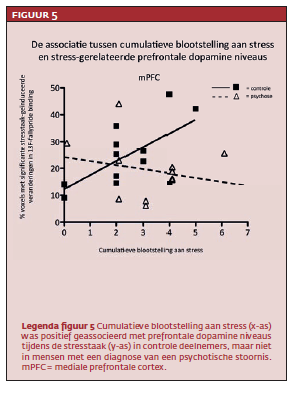
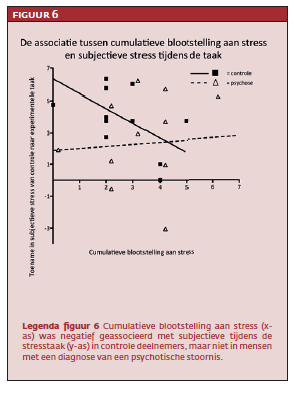
Er werden geen grote of significante verschillen gevonden in stresstaak-geïnduceerde veranderingen in prefrontale dopamineniveaus tussen controles en mensen met een psychotische stoornis (zie figuur 4). Echter, een significante interactie tussen groep (controle, psychose) en blootstelling aan trauma werd gevonden in het model van stressgerelateerde dopamineniveaus in de mediale prefrontale cortex (T=3.35, p=<.01). Follow-up-analyses onthulden in de controlegroep een positief verband tussen cumulatieve blootstelling aan stress en stressgerelateerde dopamine niveaus in de mediale prefrontale cortex (T=-3.35, p<.01). Op gedragsmatig niveau bestond er een negatieve associatie tussen cumulatieve bloostelling aan stress en subjectieve stress (T=-2.5, p=.03). Dus, méér blootstelling aan stress voorspelde hogere mediale prefrontale dopamineniveaus én minder subjectieve stress tijdens de stresstaak in controles (zie figuur 5 en figuur 6).
In de groep van mensen met een psychotische stoornis was er geen statistisch verband tussen cumulatieve blootstelling aan stress en stressgerelateerde mediale prefrontale dopamineniveaus of subjectieve stress (zie eveneens figuur 5 en 6).
Discussie
Het doel van de hier gepresenteerde studies was om nieuwe inzichten te verkrijgen in de hersenmechanismen betrokken bij stressverwerking. In deze zoektocht hebben we kunnen aantonen dat het dopaminesysteem, met specifieke focus op de prefrontale cortex, hier een belangrijke rol in speelt. Alhoewel voorop moet worden gesteld dat de steekproeven voor deze experimenten bescheiden waren en dat replicatie essentieel is, hebben we stressspecifieke dopamineniveaus in de prefrontale cortex kunnen relateren aan subjectieve stressbeleving alsmede kwetsbaarheid voor psychotische stoornissen. Deze resultaten suggereren dat de ‘psychotogenische’ effecten van stress via het dopaminesysteem werken, een bevinding die ook recentelijk is aangetoond door collega’s (Mizrahietal., 2012). Dit werk draagt bij aan nieuwe inzichten in hoe stress ons kwetsbaar maakt voor psychische klachten.
De resultaten van experiment één suggereren dat de effecten van stress op het dopaminesysteem en de subjectieve stressbeleving mede genetisch bepaald zijn. Dragers van de comt Val/Val-variant vertoonden hogere prefrontale dopamineniveaus tijdens de stresstaak dan dragers van de comt Val/Met of Met/Met-variant. Op gedragsmatig niveau waren Val/Val-dragers beter beschermd tegen de stresstaak. Hogere prefrontale dopamineniveaus tijdens stress kunnen dus een marker zijn voor toegang hersenactiviteit om stress efficiënt te verwerken, maar er is meer onderzoek nodig om dit vast te stellen.
Dat het dopaminesysteem ook betrokken is bij stressgerelateerd gedrag in het dagelijks leven werd aangetoond in experiment twee. Eerder onderzoek heeft al laten zien dat zowel dopamine-metabolieten in urine (Myin-Germeys et al., 2005) als comt-genotype (Collipet al., 2011)3 stressgevoeligheid in het dagelijks leven kunnen voorspellen. In studie twee hebben wij een concreet hersenmechanisme kunnen koppelen aan deze eerdere bevindingen: de prefrontale cortex. We zagen dat lage stressgerelateerde prefrontale dopamineniveaus voorspellend waren voor een psychische kwetsbaarheid voor stress in het dagelijks leven. Hogere dopamineniveaus gingen evenwel gepaard met een bescherming voor stress in het dagelijks leven: deze mensen rapporteerden weinig tot geen psychische klachten naar aanleiding van stress in hun dagelijks leven.
Samen genomen tonen experiment één en twee aan dat lage prefrontale dopamineniveaus niet ‘wenselijk’ zijn tijdens stressverwerking. Dit sluit nauw aan bij dieronderzoek dat laat zien dat experimentele vermindering van dopamine niveaus in de cortex een stressgevoelig fenotype creëert (Paniet al., 2000). Een afname van frontale dopamineniveaus lijkt ook in verband te staan met een toename in dopamineniveaus in het striatum. Interessant genoeg zijn verhoogde dopamineniveaus in het striatum een zeer consistente bevinding bij mensen met een psychotische stoornis (Howes & Kapur, 2009). Daarnaast verhoogt stress striatale dopamineniveaus in individuen met een kwetsbaarheid voor psychose (Mizrahiet al., 2012). Het is daarom goed mogelijk dat een psychotische kwetsbaarheid voor stress zowel gepaard gaat met lage prefrontale dopamineniveaus én verhoogde striatale niveaus; een disbalans dus. Alhoewel deze interpretatie wordt bevestigd door de beschikbare literatuur, liet het design van onze studie het niet toe om zulke hypotheses te toetsen.
Gezien het feit dat experiment één en twee werden uitgevoerd bij een niet-klinische steekproef, is een terechte vraag: ‘In hoeverre zijn deze bevindingen klinisch relevant? In een poging om deze vraag te beantwoorden onderzochten wij in experiment drie de relatie tussen langdurige stress, het dopaminesysteem en psychotische klachten in een controle en klinische sample. Gezien de uitkomsten van experiment één en twee verwachtten wij dat chronische stress dopamineniveaus in de cortex zou dempen en daardoor mensen stressgevoelig maakt. Verassend genoeg leek het omgekeerde waar te zijn: controledeelnemers die aan méér stress waren blootgesteld lieten hogere dopamineniveaus zien. Op gedragsmatig niveau ervoeren zij minder stress.
Deze resultaten houden mogelijk verband met de observatie dat stress ook adaptieve processen in werking kan stellen (Gluckman et al., 2009; Nederhof & Schmidt, 2012)817. Dat wil zeggen dat stress tijdens de ontwikkeling breinveranderingen teweeg kan brengen die sommige individuen beter laten omgaan met uitdagingen in hun omgeving. Dit aanpassingsvermogen kan ertoe leiden dat deze individuen later in het leven beter beschermd zijn tegen stressoren, zoals onze stresstaak.
Opmerkelijk genoeg waren deze associaties niet aanwezig bij mensen met een psychotische stoornis. Met de kanttekening dat de hoeveelheid trauma gemiddeld tot laag was, zou dit kunnen aantonen dat mensen met een psychotische kwetsbaarheid dit adaptieve vermogen in een stressvolle omgeving niet bezitten. Omdat het brein zich niet ideaal aanpast aan de omgeving, zou een hoge blootstelling aan stress in deze mensen psychotische symptomen kunnen uitlokken. Longitudinale studiedesigns zijn echter essentieel om zulke conclusies hard te maken. Wat voor nu bekend lijkt te zijn is dat blootstelling aan stress een vingerafdruk achterlaat op de hersenmechanismen rondom stressverwerking.
Stressinterventies gericht op het dopaminesysteem
Nieuwe inzichten in de breinmechanismen achter de stressreactie bieden mogelijkheden voor interventies, vermeldden we in de introductie. Het is daarom belangrijk om te evalueren in hoeverre toekomstige stressinterventies zich moeten richten op het dopaminesysteem.
Op het moment van schrijven zijn wij bezig met een aantal vervolgstudies, om zo te toetsen of de geïdentificeerde mechanismen geschikt zijn voor stressinterventies. Zo werken we aan een grootschalige studie waarin wordt onderzocht of acceptance- en commitment-therapie mensen minder stressgevoelig maakt. Bij deze therapie leert de cliënt zijn/haar aandacht te richten op belangrijke zaken in het leven (doelen of waarden) en speelt acceptatie van onveranderbare zaken (gedachten en emoties) een belangrijke rol(Jansen & Batink, 2014)10. Tegelijkertijd kijken we, voor en na de behandeling, hoe het dopaminesysteem op stress reageert. Een tweede vervolgstudie onderzoekt of farmacologische manipulatie van het dopaminesysteem een verandering in stressgevoeligheid teweeg kan brengen. Beide aanpakken kunnen waardevol blijken in het geval dat we psychische klachten willen uitstellen of zelfs, als ultiem doel, voorkomen.
Alhoewel dit soort interventiestudies essentieel zijn is het belangrijk om niet te vergeten dat het gepresenteerde werk gericht is op een psychotische kwetsbaarheid voor stress. Naast interventiestudies zal dus ook moeten worden getoetst of verhoogde stressgevoeligheid in depressie, angststoornissen en posttraumatische stress stoornis via het dopaminesysteem werkt. Concluderend: onze bevindingen dragen bij aan de identificatie van stressinterventiemechanismen, maar belangrijke vragen over de generaliseerbaarheid en klinische relevantie blijven over voor toekomstig onderzoek.
1 Deze studies maakten deel uit van Prof. Dr. Inez Myin-Germeys’ NWO VIDI en ERC Consolidator (EU) beurs. De data gepresenteerd in deze artikelen zijn gepubliceerd in peer-reviewed vakbladen en zijn bewerkte versies van:
1) Hernaus, D., Collip, D., Lataster, J., Ceccarini, J., Kenis, G., Booij, L., . . . Myin-Germeys, I. (2013). COMT Val158Met genotype selectively alters prefrontal [18F]fallypride displacement and subjective feelings of stress in response to a psychosocial stress challenge. PLoS One, 8(6), e65662. doi: 10.1371/journal.pone.0065662
2) Hernaus, D., Collip, D., Kasanova, Z., Winz, O., Heinzel, A., van Amelsvoort, T., . . . Myin-Germeys, I. (2015). No evidence for attenuated stress-induced extrastriatal dopamine signaling in psychotic disorder. Transl Psychiatry, 5, e547. doi: 10.1038/tp.2015.37
3) Hernaus, D., Collip, D., Lataster, J., Viechtbauer, W., Myin, E., Ceccarini, J., . . . Myin-Germeys, I. (2015). Psychotic reactivity to daily life stress and the dopamine system: a study combining experience sampling and [18F] fallypride positron emission tomography. J Abnorm Psychol, 124(1), 27-37. doi: 10.1037/abn0000010
4) Kasanova, Z., Hernaus, D., Vaessen, T., van Amelsvoort, TA., Winz, O., . . . Myin-Germeys, I. (2015). Early-life stress aff ects stress-related PFC dopamine activity in healthy adults, but not in individuals with psychotic disorder. Under review.