Neurocognitieve stoornissen bij patiénten met AUD
Jarenlang overmatig alcoholgebruik met daarbij een slecht en onregelmatig eetpatroon kan leiden tot stoornissen in het cognitief functioneren (Crews et al., 2005; Harper, 2009; Kalivas & Volkow, 2005; McCrady & Smith, 1986; Oscar- Berman & Marinkovic, 2007)16253152. Een alcoholinname van meer dan 21 glazen per week blijkt een risicofactor te zijn voor het ontwikkelen van neurocognitieve stoornissen door alcohol (Jue & Schilt, 2009)24. Geschat wordt dat er bij ongeveer de helft van de patiënten met Alcohol Use Disorders (AUD), sprake is van neurocognitieve stoornissen ten gevolge van het alcoholgebruik (Bruijnen et al., 2016)12. Deze neurocognitieve stoornissen kunnen optreden ruim voordat neurologische verschijnselen, zoals loopstoornissen, oogbewegingsstoornissen en verwardheid, zichtbaar zijn. Bij ongeveer tien procent van de patiënten met AUD is sprake van ernstige neurocognitieve stoornissen, bijvoorbeeld het syndroom van Korsakov (Rourke & Grant, 2009; Dry et al., 2012)1940. Bij patiënten met een dergelijke ernstige aandoening zijn de cognitieve stoornissen evident en worden de geheugenstoornissen, de executieve problemen en de hiermee samenhangende persoonlijkheidsveranderingen (waaronder apathie en gedragsproblemen) doorgaans snel opgemerkt. Echter, de subtielere neurocognitieve stoornissen door alcohol worden vaak overschaduwd door andere problematiek, zoals de verslaving zelf, problemen in de woon- en werkomstandigheden, problemen in de relationele sfeer en (ernstige) gezondheidsproblemen.
De DSM-5 (APA, 2013) maakt een kwalitatief onderscheid tussen ‘beperkte’ oftewel vormen van neurocognitieve stoornissen ten gevolge van alcoholafhankelijkheid die doorgaans tot minder problemen in het dagelijks leven leiden en ‘uitgebreide’ oftewel ernstige neurocognitieve stoornissen met een grote impact op het dagelijks leven (waaronder het syndroom van Korsakov). De neurocognitieve stoornissen en de ernst in de beperking als gevolg hiervan kunnen worden opgevat als een continuüm (Simpson 2014)43. Deze opvatting geeft het neuropsychologisch onderzoek een prominente plek in de classificatie, diagnostiek en behandeling van neurocognitieve stoornissen bij stoornissen in het gebruik van alcohol (Walvoort et al., 2016a)55.
Neurocognitieve stoornissen komen op de volgende neuropsychologische domeinen tot uiting: lichte tot ernstige problemen met betrekking tot de aandacht, het geheugen, de visueel-ruimtelijke functies, de plannings- en organisatievermogens, de flexibiliteit van denken, het nemen van beslissingen en het werkgeheugen (ook wel executieve functies genoemd) en de sociaal-cognitieve functies (Bates et al., 2002; Goldstein et al., 2001; Scheurich, 2005; Uekerman & Daum, 2008; Wester & Kessels, 2012)922414760. De sociaal-cognitieve functies hebben betrekking op het emotioneel functioneren, zoals het adequaat kunnen beoordelen van emoties bij anderen, het inleven in de gevoelens van anderen en het interpreteren van de affectieve prosodie van taal (stemhoogte, intonatie, benadrukken van woorden, timing, ritme en pauzeren tussen woorden).
Het is bekend dat neurocognitieve stoornissen tijdens het proces van abstinentie (a) deels kunnen herstellen (Bates et al., 2002; Loeber et al., 2009; Mann et al., 1999)2728, (b) redelijk stabiel kunnen blijven over een periode van een jaar (Horton et al., 2015; Stavro et al., 2013)2345 en (c) zelfs tot zes jaar later nog kunnen verbeteren, hetgeen is aangetoond voor het executief functioneren (Fein et al., 2006; McCrady & Smith, 1986)20. De combinatie van het toedienen van thiamine (vitamine B1) en een normaal dieet zijn van essentieel belang voor het cognitief herstel (CBO, 2009; Martin et al., 2003; Thomson et al., 2013; Stavro et al., 2013)3046. De mate van het herstel hangt samen met abstinentietijd (McCrady & Smith, 1986; Stavro et al., 2013) en leeftijd (Goldman, 1983)21. Het actuele toestandsbeeld dient beoordeeld te worden in de context van reeds bestaande premorbide cognitieve stoornissen en persoonlijkheidskenmerken, het opleidingsniveau en het arbeidsverleden (Yücel et al., 2007)62.
Van alcoholgebruik is bekend dat er een causaal verband bestaat met het ontwikkelen van angst en depressie, maar evenzo kunnen reeds bestaande psychische stoornissen en persoonlijkheidstrekken de kans op alcoholverslaving vergroten (Verheul et al., 1999)51. Persisterende angstklachten en depressieve gevoelens, alsook alcohol-gerelateerde somatische gezondheidsproblemen kunnen – door suboptimaal presteren – van invloed zijn op de uitkomsten en de interpretatie van het (neuro)psychologisch onderzoek (Wekking et al., 2004)59. Het risico op het krijgen van gezondheidsproblemen neemt toe naarmate het aantal jaren dat gedronken wordt hoger is. Deze gezondheidsproblemen bestaan uit motorische problematiek (evenwicht, houding, loopstoornissen die tijdelijk of blijvend van aard zijn), diabetes, schildklierproblematiek, leverfunctiestoornissen, hersenletsel door valpartijen, vaatproblematiek, hartproblematiek, hoge bloeddruk, longproblemen vanwege comorbide nicotineverslaving en kanker (Brust, 2010; CBO, 2009; Wekking et al., 2004).
Invloed van alcoholonttrekking, cognitieve stoornissen en ziekte-inzicht op het diagnostisch proces
Ten behoeve van diagnostiek en indicatie, maar ook voor behandelevaluatie (bijvoorbeeld met Routine Outcome Monitoring; zie: https://www.sbggz.nl/Documenten) wordt in de verslavingszorg frequent gebruik gemaakt van zelfrapportagevragenlijsten om informatie te verzamelen over aanwezige psychische klachten, persoonlijkheidstrekken, adaptieve vermogens en het evalueren van de gekozen behandelinterventie. Bij patiënten met AUD kunnen de uitkomsten van zelfrapportagevragenlijsten op de volgende wijze vertekend kunnen worden:
- Alcoholonttrekking kan emotionele en somatische klachten veroorzaken die tijdens de eerste weken (de acute fase) van abstinentie moeilijk te onderscheiden zijn van eventuele onderliggende psychische stoornissen (Becker, 2008; Schuckit, 2009)1142. Dit betekent dat als het cognitief en emotioneel functioneren in een te vroeg stadium middels zelfrapportage in kaart gebracht wordt enkel de tijdelijke gevolgen van de alcoholonttrekking worden gemeten, zoals prikkelbaarheid, agitatie, somberheid angstklachten, slaapproblemen en pijnklachten (Becker, 2008; Schuckit, 2009).
- Cognitieve stoornissen en een verminderd ziekte-inzicht zorgen ervoor dat patiënten zelfrapportagevragenlijsten vaak als ‘probleemloos’ invullen, waardoor problemen en klachten onderschat worden en overschatting van het functioneren op de loer ligt. Een behandelaar dient waakzaam te zijn dat alcoholonttrekking kan leiden tot een verhoogde kans op over-diagnosticeren van de gevonden klachten en dat cognitieve stoornissen en een verminderd ziekte-inzicht kunnen leiden tot een verhoogde kans op onder-diagnosticeren van de gevonden klachten (Walvoort, 2016)54.
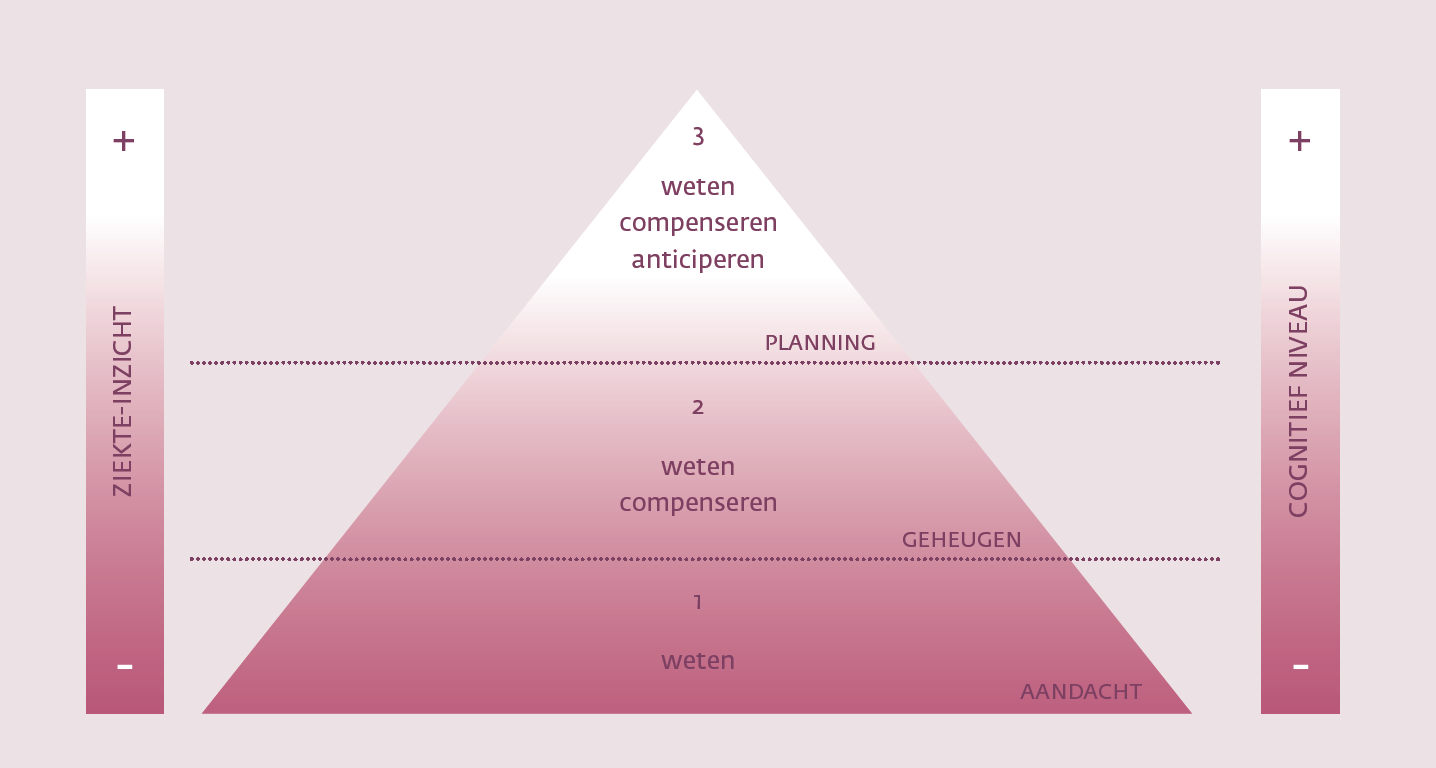
Er wordt gesproken van een tekort aan ziekte-inzicht of anosognosie (Babinski, 1914)8 bij patiënten in de verslavingszorg die weliswaar door het drankgebruik vastlopen in het dagelijks leven, maar geen problemen zeggen te ervaren en daarmee ook geen noodzaak zien om in behandeling te gaan. Gebaseerd op ervaringen uit de praktijk hebben Crosson en collega’s (1989)17 een trapsgewijs model voor ziekte-inzicht ontwikkeld dat uit drie niveaus bestaat. Het laagste niveau is weten dat er een probleem is; het volgende niveau is het herkennen van het probleem en hiervoor gaan compenseren op het moment dat het zich voordoet; en het derde en hoogste niveau is de vaardigheid om te kunnen anticiperen op het probleem zelfs al voordat het zich heeft aangediend. Dit laatste niveau vereist intacte planningsvermogens en een intact geheugen.
Dit trapsgewijze model is door Van Schouwen-van Kranen (2014)49 verder uitgewerkt door de integratie met het hiërarchisch model van cognitief functioneren van Allen (Allen et al., 1992)2. In dit model worden de aandachtsfuncties als basisvaardigheid gezien, gevolgd door de daarop gebouwde geheugenfuncties en tot slot de executieve functies als meest complexe cognitieve vaardigheid . Een beter ziekte-inzicht correspondeert met betere cognitieve prestaties. Andersom geldt dat een patiënt zich bewust kan zijn dat er een probleem is, maar de cognitieve vaardigheden mist om hiervoor behandeling te zoeken. Het spreekt voor zich dat dit alles consequenties kan hebben voor de diagnostiek en behandeling binnen de verslavingssector – en overigens ook daarbuiten. Door enkel gebruik te maken van zelfrapportagevragenlijsten kunnen de cognitieve problemen over het hoofd worden gezien en dit kan leiden tot zowel verkeerde conclusies als verkeerde behandelinterventies, zoals blijkt uit een recente studie van Walvoort et al. (2016b)56. Hierin werd de relatie tussen zelf-gerapporteerde cognitieve klachten middels de Minnesota Multiphasic Personality Inventory-2-Restructured Form (MMPI-2RF; Van der Heijden et al., 2013)48 en de feitelijke prestaties op cognitieve taken onderzocht door twee vergelijkbare patiëntgroepen met ernstige (Korsakovsyndroom) en beperkte neurocognitieve stoornissen door alcohol met elkaar te contrasteren. Zoals verwacht rapporteerden Korsakov-patiënten geen cognitieve of neurologische klachten op de zelfrapportage vragenlijst (MMPI-2RF) terwijl er wel degelijk sprake was van evidente cognitieve stoornissen zoals bleek uit neuropsychologische tests, waarbij een gebrek aan ziekte-inzicht in de beperkte neurocognitieve stoornissengroep minder prominent naar voren kwam. Dit komt overeen met studies die aantonen dat patiënten met AUD de hoeveelheid genuttigde alcohol onderschatten (Lincoln et al., 2011)26, maar ook de duur van het alcoholgebruik en het juist inschatten van de ernstige consequenties die het alcoholgebruik heeft op het dagelijks leven (Volkow & Li, 2005).
Implicaties voor de diagnostiek bij patiënten met AUD
Om te onderzoeken of er aanwijzingen zijn voor de aanwezigheid van neurocognitieve stoornissen, kan het cognitief functioneren in kaart gebracht en gemonitord worden door gebruik te maken van cognitieve screeners, zoals de Montreal Cognitive Assessment (MOCA; Alarcon et al., 2015; Nasreddine et al., 2005; Ridley et al., 2017)13338. Door de prestaties te vergelijken met te verwachten prestaties op basis van gegevens uit het dossier, zoals opleidingsniveau en werkverleden van de patiënt, kan duidelijk worden gemaakt of er aanwijzingen zijn voor mogelijke cognitieve stoornissen. Doordat er meerdere parallelle versies beschikbaar zijn, is dit instrument geschikt om veranderingen van het cognitief functioneren te meten. Indien er aanwijzingen zijn voor de aanwezigheid van cognitieve stoornissen kan er vervolgens uitgebreider neuropsychologische diagnostiek worden verricht waardoor duidelijk wordt welke cognitieve functies aangedaan zijn en waar in de behandeling rekening mee gehouden dient te worden.
Om te voorkomen dat enkel de effecten van alcoholonttrekking worden gemeten, verdient het de voorkeur om neuropsychologisch onderzoek pas uit te voeren na minimaal zes weken abstinentie (Walvoort et al., 2013)53. De gevolgen van alcoholonttrekking op het klinische beeld kunnen tot en met de vijfde week van abstinentie duren alvorens herstel optreedt naar een enigszins stabiel niveau van (cognitief) functioneren (Walvoort et al., 2017). Als ingeschat wordt dat er (ernstige) gezondheidsrisico’s spelen kan veilig gedetoxed worden middels een opname in de kliniek. Dit verkleint de kans op, bijvoorbeeld, alcoholonttrekkingsinsulten. Als ingeschat wordt dat de gezondheidsrisico’s klein zijn, kan gekozen worden voor een poliklinische ontgiftingsfase. Dit zogenoemde ‘detoxen’ dient bij voorkeur door deskundigen, zoals een verslavingsarts, te worden begeleid (CBO, 2009). Na de detoxfase kan de abstinentie gemonitord worden door alcoholcontroles (urinecontrole of blaastest).
De informatie die patiënten gegeven kan behoorlijk verschillen van de informatie die door familieleden, naastbetrokkenen en behandelaren wordt gegeven over de ervaren klachten en het cognitief functioneren (Verdejo- García & Perez-García, 2008)50. Dit verschil wordt gebruikt om de mate van ziekte-inzicht in te kunnen schatten. De uitkomsten van een vragenlijst die door de patiënt is ingevuld, wordt dan vergeleken met de uitkomst van een vragenlijst die is ingevuld door een informant die de patiënt goed kent. Voorbeelden van dergelijke vragenlijsten zijn de Dysexecutive Questionnaire (DEX-vragenlijst; Wilson et al, 1996)61, een vragenlijst om executieve problemen op te sporen, en de Patient Competency Rating Scale (PCRS; Prigatano, 1986)37, een vragenlijst die inzicht geeft in het globaal cognitief, emotioneel/gedragsmatig en lichamelijk functioneren. Bij patiënten met AUD met ernstige psychopathologie kan de Q8 worden gebruikt (Walvoort et al., 2016c)57. De Q8 is een korte vragenlijst bestaande uit acht vragen die door de patiënt ingevuld moeten worden (zie figuur 2)[/anchor]. Na het invullen van deze lijst worden de Q8-items beoordeeld op hun adequaatheid door een clinicus die de patiënt goed kent. De Q8 is in staat om onderscheid te maken tussen patiënten met ernstige cognitieve stoornissen (Korsakov) en beperkte cognitieve stoornissen, waarmee het een bijdrage levert aan de diagnostiek van het syndroom van Korsakov.
Het combineren van de informatie verkregen uit vragenlijsten (ingevuld door de patiënt en iemand die de patiënt goed kent), hetero- en autoanamnese en objectieve prestatietests (zgn. multimethod en multisource) geeft zicht op psychopathologie, cognitieve klachten, cognitief functioneren en ziekte-inzicht. Aan de hand van deze informatie kan er een sterkte- en zwakteprofiel van vaardigheden worden opgesteld die als bouwstenen kunnen dienen om de volgende behandelfase in te richten. Aangezien bij volgehouden abstinentie er verbetering plaatsvindt in het cognitief functioneren, is herhaald meten geschikt om veranderingen in het cognitief functioneren vast te kunnen stellen.
Implicaties voor indicatiestelling en (thuis)behandeling
De neurocognitieve stoornissen die in de diagnostiekfase zijn vastgesteld, dienen als uitgangspunt om de daaropvolgende behandelfase in te richten. Door te compenseren voor de neurocognitieve stoornissen en gebruik te maken van de gevonden sterke kanten, kan toegewerkt worden naar het verkleinen van de kans op terugval in alcoholgebruik en het vergroten van de sociaal-maatschappelijke zelfredzaamheid. Patiënten met neurocognitieve stoornissen door alcohol hebben problemen om aangeboden informatie te begrijpen, te verwerken, te herinneren en toe te passen op de eigen situatie, hetgeen de behandeling bemoeilijkt (Bates et al., 2013)10. Hoewel er meestal duidelijke behandelafspraken worden gemaakt op het kantoor van de hulpverlenende instantie, lukt het patiënten met neurocognitieve stoornissen door alcohol vaak onvoldoende om deze afspraken na te komen. Daarnaast doen programmaonderdelen in de zorg veelal een beroep op cognitieve vaardigheden die juist bij deze patiënten zijn aangedaan, waardoor de patiënten (onbedoeld) overvraagd kunnen worden door de behandelaar (Allen et al., 1997)3. Hierdoor is het risico op terugval in alcoholgebruik en het voortijdig afbreken van de behandeling groot (Manning et al., 2008; Scheurich, 2005)29.
De kans op terugval in alcoholgebruik wordt minder als er rekening gehouden wordt met de gevonden cognitieve mogelijkheden en beperkingen. Essentieel in de behandeling van patiënten met neurocognitieve stoornissen is het vormgeven van een dag- en vrijetijdsbesteding. Daarnaast kan per patiënt bekeken worden of thuishulp ingeschakeld moet worden, afhankelijk van het functioneren. Door de inzet van casemanagers die naar de thuissituatie van de patiënt gaan, in plaats van dat de patiënt naar kantoor komt voor gesprekken, kunnen problemen snel gesignaleerd worden. Vervolgens kan het gedrag tijdig bijgestuurd worden waardoor de kans op een (her)opname verkleind wordt. In het geval van een opname in de kliniek verdient het de voorkeur om de casemanagers al tijdig in het klinisch traject in te zetten. Samen met de patiënt en naasten kan de overgang naar de thuissituatie concreet en zorgvuldig voorbereid worden, waarbij psycho-educatie geboden kan worden niet alleen aan verwanten en/of naasten van een patiënt maar ook aan aanbieders van zorg. Naast een dag- en vrijetijdsbesteding is het wenselijk om minimaal twee keer per week een urinecontrole te plannen. Ervaring leert dat dit ondersteunend werkt voor de patiënt en daarnaast zijn dit twee contactmomenten met een hulpverlener. Bij verzuim van afspraken kan er snel contact met de patiënt worden gemaakt.
Door de inzet van casemanagers wordt zorg op maat geleverd in de thuissituatie, waardoor de opnameduur in de kliniek mogelijk verkort kan worden en het aantal (her)opnames verminderd. Hierbij moet opgemerkt worden dat patiënten met neurocognitieve stoornissen door alcohol, tijd nodig hebben om 1) abstinent te worden en te blijven en 2) de (nieuw) aangeleerde structuur en (nieuwe) levenswijze te borgen in het alledaags leven. Daarnaast hebben ook behandelaars tijd nodig om zaken adequaat te kunnen regelen of aanvragen bij diverse instanties succesvol te kunnen vormgeven.
Een voorbeeld hiervan is het aanvragen van mentorschap of bewindvoering, een proces dat veel wachttijd in beslag kan nemen voor definitieve afhandeling. Ontslag uit de kliniek vóórdat dit geregeld is leidt veelal tot een snellere terugval. Behandeling richt zich niet uitsluitend op de individuele patiënt, maar ook op hun familieleden of andere naasten. Sociale steun is van groot belang voor het maatschappelijk herstel van patiënten met (Sommer et al., 2013)44.
Tot besluit
Alcoholonttrekking, tijdelijke abstinentie-effecten, cognitieve stoornissen en verminderd ziekte-inzicht kunnen het klinisch beeld bij patiënten met AUD verstoren. Door rekening te houden met deze verstorende effecten tijdens de diagnostiekfase kan er een betrouwbaar en valide cognitief profiel worden opgesteld met sterktes en zwaktes van de patiënt, waarmee de daaropvolgende behandelfase beter en effectiever kan worden ingericht.
Door het opnemen van meerdere meetmomenten tijdens de behandeling kan de behandelaar de behandeling verfijnen en is de verwachting dat deze (geïndividualiseerde) behandelaanpak de kans op overvraging en het voortijdig afbreken van de behandeling wordt verkleind. Deze wisselwerking tussen diagnostiek en behandeling vormt een cyclisch proces zodat het herstel van cognitieve vaardigheden tijdens volgehouden abstinentie kan worden gemonitord en, zonodig, bijgesteld.
Tot slot zou de behandeling bij patiënten met neurocognitieve stoornissen door alcohol na de klinische opname veel meer naar de thuissituatie gebracht kunnen worden in plaats van dat de patiënt ‘naar de zorg’ komt. In het laatste geval wordt er een te groot appèl gedaan op het zelf-oplossend en zelf-organiserend vermogen van patiënten met neurocognitieve stoornissen door alcohol (Walvoort et al., 2017)58. De neurocognitieve stoornissen door alcohol kunnen dan, onterecht, worden uitgelegd als niet gemotiveerd zijn voor de behandeling (Rinn et al., 2002)39, waardoor er een verhoogde kans is op terugval en (her)opname in klinische voorzieningen.
Correspondentie aangaande dit artikel: Dr. Serge Walvoort, Vincent van Gogh voor Geestelijke Gezondheidszorg, Stationsweg 46, 5803 AC Venray. E-mail: swalvoort@vvgi.nl. De auteurs danken de teams, behandelaren en casemanagers van het TCvK, in het bijzonder Linda Paijens-Hieminga (casemanager thuisbehandeling).
Literatuurlijst
- Alarcon, R., Nalpas, B., Pelletier, S. & Perney, P. (2015). MoCA as a screeningtool of neuropsychological defi cits in alcohol-dependent patients. Alcoholism: Clinical and Experimental Research, 39, 1042-1048.
- Allen, C.K., Earhart, C.A. & Blue, T. (1992) Occupational therapy treatment goals for the physically and cognitively disabled. Rockville, MD: American Occupational Therapy Association.
- Allen, D.N., Goldstein, G. & Seaton, B.E. (1997). Cognitive rehabilitation of chronic alcohol abusers. Neuropsychology Review, 7, 21-39.
- American Psychiatric Association (2000). Diagnostic and statistical manual of mental disorders (4th ed., text rev.). APA, Washington, DC.
- American Psychiatric Association (2007). Diagnostische criteria van de DSM-IV-TR. Amsterdam: Pearson.
- American Psychiatric Association (2013). Diagnostic and statistical manual of mental disorders (5th ed.). Washington, DC.
- American Psychiatric Association (2014). DSM-5. Handboek voor de classifi catie van psychische stoornissen. Amsterdam: Boom.
- Babinski, M.J. (1914). Contibution a l’etudedes troubles mantaux dans l’hemiplegie organique cerebrale (anosognosie). Revue Neurologique, 12, 845–848.
- Bates, M.E., Barry, D. & Bowden, S.C. (2002). Neurocognitive impairment associated with alcohol use disorders: implication for treatment. Experimental and Clinical Psychopharmacology, 10, 193-212.
- Bates, M.E., Voelbel, G.T., Buckman, J.F., Labouvie, E.W. & Barry, D. (2013). Short term neuropsychological recovery in clients with substance use disorders. Alcoholism: Clinical and Experimental Research, 29, 367-377.
- Becker, H.C. (2008). Alcohol dependence, withdrawal, and relapse. Alcohol, Research and Health, 31, 348-361.
- Bruijnen, C.J.W.H., Kessels, R.P.C., Dijkstra, B.A.G., Walvoort, S.J.W., Wester, A.J. & de Jong, C.A.J. (2016). Montreal Cognitive Assessment-Dutch (MOCA-D). Een cognitieve screener in de Nederlandse reguliere verslavingszorg. Nijmegen: NISPA.
- Bourgeois, M.L., Koleck, M. & Roig-Morrier, R. (2002a). Awareness of disorder (its measure in 100 psychiatric inpatients). Annales Médico Psychologiques, 160, 444-450.
- Bourgeois, M.L., Koleck, M. & Jais, E. (2002b). Validation of the insight Q8 scale and evaluation of the awareness disorder in 121 psychiatric inpatients. Annales Médico Psychologiques, 160, 512-517.
- CBO Richtlijn (2009). Stoornissen in het gebruik van alcohol. Richtlijn voor de diagnostiek en behandeling van volwassen patiënten met een stoornis in het gebruik van alcohol. Utrecht: Trimbos Instituut.
- Crews, F.T., Buckley, T., Dodd, P.R., Ende, G., Foley, N. et al. (2005). Alcoholic neurobiology: changes in dependence and recovery. Alcoholism: Clinical and Experimental Research, 29, 1504-1513.
- Crosson, B., Barco, P.P. & Veloza, C.A. (1989). Awareness end compensation in post acute head injury rehabilitation. Journal of Head Trauma Rehabilitation, 4, 46-54.
- David, A.S. (1990). On insight and psychosis: discussion paper. Journal of the Royal Society of Medicine, 83, 325-329.
- Dry, M., Burns, R, Nettlebeck, T., Farquharson, A.L. & White, J. M (2012). Dose-Related Effects of Alcohol on Cognitive Functioning. PloS One, 7 (11) e50977.
- Fein, G., Torres, J., Price, L. & DiScalfani, V. (2006). Cognitive performance in long-term abstinent alcoholic individuals. Alcoholism: Clinical and Experimental Research, 30, 1538-1544.
- Goldman, M.S. (1983). Cognitive impairment in chronic alcoholics. Some cause for optimism. American Psychology, 38, 1045-1054.
- Goldstein, R.Z., Volkow, N.D., Wang, G., Fowler, J.S. & Rajaram, S. (2001). Addiction changes orbitofrontal gyrus function: involvement in response inhibition. Neuroreport, 12, 2595-2599.
- Horton, L., Duffy, T., Hollins, M.C. & Martin, C.R. (2015). Comprehensive assessment of alcohol-related brain damage (ARBD): gap or chasm in the evidence? Journal of Psychiatric and Mental Health Nursing, 22, 3-14.
- Jue, P. & Schilt, T. (2009). Alcoholgerelateerde cognitieve stoornissen (pp. 243-251). In: Jonker, C., Slaets, J.P.J., Verhey, F.R.J., editors. Handboek dementie. Laatste inzichten in diagnostiek en behandeling. Houten: Bohn Staffleu.
- Kalivas, P.W. & Volkow, N.D. (2005). The neural basis of addiction: A pathology of motivation and choice. American Journal on Psychiatry, 162, 1403-1413.
- Lincoln, R., Rosenthal, C.F., Malte, C.A. & Simpson, T. (2011). A pilot study of memory impairment associated with discrepancies between retrospective and daily recall of alcohol consumption. American Journal on Addiction, 20, 568-574.
- Loeber, S., Duka, T., Welzel, H., Nakovics, H., Heinz, A. & Mann, K. (2009). Cognitive effects: Impairment of cognitive abilities and decision making after chronic use of alcohol: the impact of multiple detoxifi cations. Alcohol & Alcoholism, 44, 372-381.
- Mann, K., Günther, A., Stetter, F. & Ackermann, K. (1999). Rapid recovery from cognitive defi cits in abstinent alcoholics: a controlled test-retest study. Alcohol & Alcoholism, 34, 567-574.
- Manning, V., Wanigaratne, S., Best, D., Hill, R.G., Reed, L.J. et al. (2008). Changes in Neuropsychological Functioning during Alcohol Detoxifi cation. European Addiction Research, 14, 226-233.
- Martin, P.R., Singleton, C.K. & Hiller-Sturmhöfel, S. (2003). The Role of Thiamine Defi ciency in Alcoholic Brain Disease. Alcohol Research Health, 27, 134-142.
- McCrady, B.S. & Smith, D.E. (1986). Implications of cognitive impairment for the treatment of alcoholism. Alcoholism: Clinical and Experimental Research, 10, 145-149.
- Moeller, S.J. & Goldstein, R.Z. (2014). Impaired self-awareness in human addiction: defi cient attribution of personal relevance. Trends in Cognitive Sciences, 18, 635-641.
- Nasreddine, Z.S., Phillips, N.A., Bedirian, V., Charbonneau, S., Whitehead, V. et al. (2005). The Montreal Cognitive Assessment, MoCA: a Brief Screening Tool for Mild Cognitive Impairment. Journal of the American
- Geriatric Society, 53, 695-699.
- Oscar-Berman, M. & Marinkovic, K. (2007). Alcohol: E© ects on neurobehavioral functions and the brain. Neuropsychology Reviews, 17, 239-257.
- Philippi, C.L., Feinstein, J.S., Khalsa, S.S., Damasio, A., Tranel, D. et al. (2012). Preserved self-awareness following extensive bilateral brain damage to the insula, anterior cingulate, and medial prefrontal cortices. PloS One, 7, e38413. doi:10.1371/journal.pone.0038413.
- Prigatano, G. P. (1986). Neuropsychological Rehabilitation After Brain Injury. Baltimore: John Hopkins University Press.
- Ridley, N., Batchelor, J., Draper, B., Demirkol, A., Lintzeris, N. & Withall, A. (2017). Cognitive screening in substance users: Diagnostic accuracies of the Mini-Mental State Examination, Addenbrooke’s Cognitive Examination– Revised, and Montreal Cognitive Assessment. Journal of Clinical and Experimental Neuropsychology, http://dx.doi.org/10.1080/13803395. 2017.1316970.
- Rinn, W., Desai, N., Rosenblatt, H. & Gastfriend, D.R. (2002). Addiction denial and cognitive dysfunction: A preliminary investigation. Journal of Neuropsychiatry and Clinical Neuroscience, 14, 52-57.
- Rourke, S.B. & Grant, I. (2009). The neurobehavioral correlates of alcoholism (pp. 398-454). In: Grant, I., & Adams, K.M. (Ed.), Neuropsychological assessment of neuropsychiatric and neuromedical disorders, 3rd ed.. New York: Oxford University Press.
- Scheurich, A. (2005). Neuropsychological functioning and alcohol dependence. Current Opinion in Psychiatry, 18, 319-332.
- Schuckit, M.A. (2009). Alcohol-use disorders. The Lancet, 373, 492-501.
- Simpson, J.R. (2014). DSM-5 and neurocognitive disorders. Journal of the American Academy of Psychiatry and the Law, 42, 159-164.
- Sommer, A., Dekkers, A. & Vanderplasschen, W. (2013). De weg naar herstel. Verslaving, 4, 51-66.
- Stavro, K., Pelletier, J. & Potvin, S. (2013). Widespread and sustained cognitive defi cits in alcoholism: a meta-analysis. Addiction Biology, 18, 203-213.
- Thomson, A.D., Marshall, E.J. & Bell, D. (2013). Time to act on the inadequate management of Wernicke’s encephalopathy in the UK. Alcohol and Alcoholism, 48, 4-8.
- Uekermann, J.& Daum, I. (2008). Social cognition in alcoholism: a link to prefrontal cortex dysfunction? Addiction, 103, 726-735.
- Van der Heijden, P., Derksen, J., Egger, J.I.M., Rossi, G., Laheij, M. & Bögels, T., (2013). MMPI-2-RF. Handleiding voor afname, scoring en interpretatie. Pen Pyschodiagnostics, Nijmegen.
- Van Schouwen-van Kranen, E.T. (2014). Clinical reasoning in cognitive rehabilitation therapy. NeuroRehabilitation, 34, 15-21.
- Verdejo-García, A. & Pérez-García, M. (2008). Substance abusers’ self-awareness of the neurobehavioral consequences of addiction. Psychiatry Research, 158, 172-180.
- Verheul, R., van den Brink, W. & Geerlings, P. (1999). A three way psychobiological model of craving for alcohol. Alcohol & Alcoholism, 34, 197-222.
- Volkow, N. & Li, T.K. (2005). The neuroscience of addiction. Nature Neuroscience, 8, 1429-1430.
- Walvoort, S.J.W., Wester, A.J. & Egger, J.I.M. (2013). Neuropsychologische diagnostiek en cognitieve functies bij alcoholabstinentie. Tijdschrift voor Psychiatrie, 55, 101-111.
- Walvoort, S.J.W. (2016). The neuropsychology of alcohol use disorder, a multimethod evaluation of cognition and illness insight. Donders Series 236, Radboud Universiteit Nijmegen.
- Walvoort, S.J.W., Wester, A.J., Doorakkers, M.C., Kessels, R.P.C. & Egger, J.I.M. (2016a) Alcoholgerelateerde cognitieve stoornissen in de DSM-5. Tijdschrift voor Psychiatrie, 58, 397-401.
- Walvoort, S.J.W., Van der Heijden, P.T., Wester, A.J., Kessels, R.P.C. & Egger, J.I.M. (2016b). Self-awareness of cognitive dysfunctions: A comparison of self-reported complaints and cognitive performance between patients with Korsakoff’s syndrome and patients with alcohol-related cognitive dysfunction. Psychiatry Research, 245, 291-296.
- Walvoort, S.J.W., Van der Heijden, P.T., Kessels, R.P.C. & Egger, J.I.M. (2016c). Measuring illness insight in patients with alcohol-related cognitive dysfunction with the Q8 questionnaire. A validation study. Neuropsychiatric Disease and Treatment, 12, 1609-1615.
- Walvoort, S.J.W., Van der Heijden, P.T., Kessels, R.P.C. & Egger, J.I.M. (2017). Cognitieve stoornissen door jarenlang alcoholgebruik of door het acuut stoppen met drinken bemoeilijkt diagnostiek en behandeling. Verslaving, 13, 124-134.
- Wekking, E., van Hout, M., van der Laan, G. In: Deelman, B., Eling, P., de Haan, E., van Zomeren, E., editors. Klinische neuropsychologie. Amsterdam: Uitgeverij Boom; 2006. p. 462-481.
- Wester, A.J., Kessels, R.P.C. Alcoholgerelateerde cognitieve stoornissen. In: Kessels, R.P.C., e.a. (Ed.), Klinische Neuropsychologie. Amsterdam: Boom; 2012
- Wilson, B.A., Alderman, N., Burgess, P.W., Emslie, H. & Evans, J.J. (1996). Manual for the Behavioural Assessment of the Dysexecutive Syndrome. Bury St. Edmunds, UK: Thames Valley Test Company. (Nederlandse vertaling: Krabbendam, L., & Kal© , A.C. (1997).)
- Yücel, M., Lubman, D.I., Solowij, N. & Brewer, W.J. (2007). Understanding drug addiction: a neuropsychological perspective. Australian and New Zealand Journal of Psychiatry, 41, 957-968.