Slaapapneu is een slaapstoornis waarbij er sprake is van het herhaald optreden van ademstilstanden tijdens de slaap. Deze ademstilstanden worden ook wel apneus genoemd. Slaapapneu gaat gepaard met zuurstofdalingen in het bloed, wat tot een tijdelijk zuurstoftekort en verhoogd koolstofdioxidegehalte leidt.
Er zijn diverse vormen van slaapapneu met verschillende oorzaken. De meest voorkomende vorm is obstructief slaapapneu (OSA), waarbij de apneus worden veroorzaakt door een afsluiting van de luchtweg. Een andere vorm is centraal slaapapneu (CSA). Bij CSA wordt vanuit de hersenen geen prikkel gegeven aan de ademhalingspieren. Ook is een combinatie van beide vormen mogelijk. De ernst van de slaapapneu wordt bepaald door het aantal apneus en gedeeltelijke ademstops (hypopneus) per uur slaap (apneuhypopneu index; AHI), waarbij een onderscheid gemaakt wordt tussen lichte (≥5), matige (≥15) en ernstige slaap apneu (≥30).
In dit artikel, dat zich focust op apneu bij patiënten met een beroerte, zal de overkoepelende term ‘slaapapneu’ worden gebruikt voor alle vormen van matige tot ernstige slaapapneu. Bij referenties naar onderzoeken waarin specifiek naar osa is gekeken, zal dat expliciet worden vermeld.
Prevalentie
De geschatte prevalentie van slaapapneu in de algemene populatie is drie tot zeventien procent (Peppard et al., 2013)27. Belangrijke risicofactoren voor het ontwikkelen van slaapapneu zijn hogere leeftijd, mannelijk geslacht, overgewicht, roken en alcoholgebruik (Young, Peppard & Gottlieb, 2002)41. Veel voorkomende symptomen van slaapapneu gedurende de nacht zijn snurken, onrustig slapen en nachtzweten. Slaapapneu kan overdag leiden tot niet uitgerust wakker worden, overmatige slaperigheid, hoofdpijn, prikkelbaarheid, somberheid en klachten van geheugen- en concentratieverlies. Een meta-analyse naar de effecten van slaapapneu op het cognitief functioneren toonde beperkingen in domeinen van vigilantie (volgehouden aandacht), verdeelde aandacht, geheugen, executief functioneren (onder meer mentale flexibiliteit en planning) en motorische coördinatie (Beebe et al., 2003)7.
Bij onderzoek naar slaapapneu wordt vaak gebruik gemaakt van een anamnesegesprek, lichamelijk onderzoek en screeningsvragenlijsten zoals de Epworth Sleepiness Scale (Johns, 1991)20 en de Berlin Questionnaire (Netzer et al., 1999)26. De Epworth Sleepiness Scale is gericht op de mate van slaperigheid overdag. Er wordt gevraagd naar de kans dat iemand indut of in slaap valt in verschillende situaties, zoals bij lezen of televisiekijken, waarbij de antwoordmogelijkheden lopen van ‘nooit’, ‘af en toe’, ‘vrij vaak’ tot ‘altijd’. Bij de Berlin Questionnaire worden drie bekende risicofactoren voor slaapapneu uitgevraagd, namelijk snurken, vermoeidheid/ slaperigheid en hoge bloeddruk. Er wordt hierbij gevraagd naar het voorkomen van, de frequentie en de ernst. Daarnaast kan gebruik gemaakt worden van pulse-oximetrie, een methode die door middel van een sensor op de vinger het aantal zuurstofdalingen in het bloed per uur bepaalt. Het aantal zuurstofdalingen geeft een indicatie van het aantal apneus per uur, waarbij meer dan vijf zuurstofdalingen per uur kan wijzen op slaapapneu.
De gouden standaard voor het vaststellen van slaapapneu is echter een uitgebreide slaapregistratie middels polysomnografie of polygrafie. Beide methodes meten gedurende de slaap de luchtstroom, zuurstofgehalte in het bloed, ademhalingsbeweging en lichaamspositie. Met polysomnografie worden daarnaast de slaapstadia bepaald met behulp van elektro-encefalografie (EEG), elektro-oculografie (EOG) en elektromyografie (EMG).
Er zijn verschillende behandelopties voor slaapapneu, waaronder (1) conservatieve methoden zoals gewichtsverlies en stoppen met roken, (2) positionele therapie waarbij slapen in rugligging vermeden wordt, (3) het gebruik van een mandibulair repositieapparaat (een gebitsprothese die de kaak naar voren houdt) en (4) een kaakoperatie. De meest gebruikte behandeling voor slaapapneu is echter continuous positive airway pressure (CPAP). CPAP verbetert het ademhalingspatroon door via een masker lucht in de neus of de mond te blazen; daardoor blijft de luchtweg geopend, verdwijnen de apneus en verbetert de slaapkwaliteit. Dit zorgt voor een vermindering van slaperigheid overdag en een betere kwaliteit van leven (Giles et al., 2006)17. De positieve effecten van CPAP op cognitief functioneren van patiënten met slaapapneu zijn tot op heden minder eenduidig. Er zijn aanwijzingen dat CPAP verbetering geeft in de domeinen van vigilantie, aandacht en geheugen (Aloia et al., 2004)5.
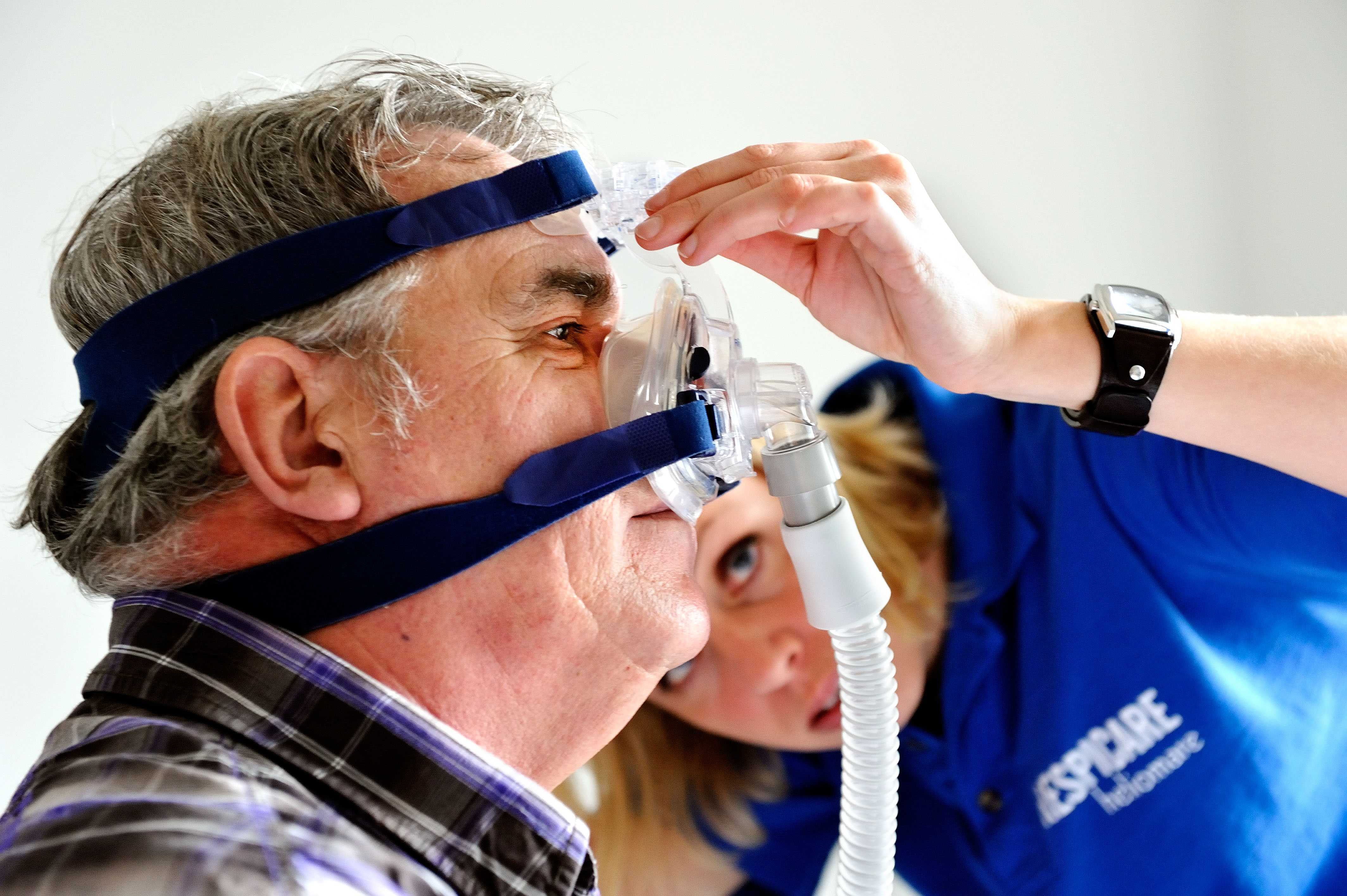
Hoewel CPAP een positief effect heeft op aan slaapapneu gerelateerde klachten, is de verbetering in de dagelijkse praktijk vaak beperkt, omdat de therapietrouw over het algemeen laag is. De gemiddelde therapietrouw van patiënten met slaapapneu varieert tussen de 17 en 54%, waarbij therapietrouw gedefinieerd wordt als meer dan vier uur CPAP-gebruik per nacht (Weaver & Gunstrein, 2008)37. Belangrijke redenen voor de lage therapietrouw zijn het geluid dat het CPAP-apparaat maakt, lekkage van het masker, huidirritaties, tranende ogen en een claustrofobisch gevoel, waardoor mensen niet goed inslapen of ’s nachts wakker worden. Daarnaast kan vermindering van intimiteit een reden zijn voor lage therapietrouw. Hoewel de CPAP-apparaten steeds kleiner, stiller en gebruiksvriendelijker zijn geworden, blijft het gebruik voor veel patiënten een onderneming (zie foto). Factoren die therapietrouw op langere termijn verbeteren, zijn goede therapietrouw in de eerste weken, hogere mate van zelfgerapporteerde slaperigheid, ernstiger mate van slaapapneu, goed probleemoplossend vermogen, en een positieve houding ten opzichte van CPAP (Rosenthal et al., 2000)30. Tevens lijken ondersteunende interventies, zoals regelmatig contact, psycho-educatie en cognitieve gedragstherapie de therapietrouw positief te beïnvloeden (Stepnowsky, Marler & Ancoli-Israel, 2002).
Slaapapneu en beroerte
Naast negatieve gevolgen in het dagelijks functioneren, verhoogt slaapapneu het risico op hart- en vaatziekten en een beroerte (cerebrovasculair accident; CVA) (Yaggi & Mohsenin, 2004)40. CVA is een verzamelnaam voor herseninfarcten en hersenbloedingen. Slaapapneu komt vaker voor bij CVA-patiënten dan in de algemene bevolking (zie boxen 1 en 2). Meerdere onderzoeken hebben aangetoond dat ongeveer 38 tot 70% van de CVA-patiënten slaapapneu heeft (Johnson & Johnson, 2010)21. Tevens blijkt dat slaapapneu bij CVA-patiënten geassocieerd is met een slechtere functionele uitkomst, langere opnameduur en een verhoogd risico op overlijden (Kaneko et al., 2003; Cherkassky et al., 2003)1022. Het effect van slaapapneu op andere aspecten van het dagelijks functioneren van CVA-patiënten, zoals het cognitief functioneren, is nog nauwelijks onderzocht.
Hoewel ook het onderzoek naar de behandeling met CPAP bij CVA-patiënten nog schaars is, is de verwachting dat CPAP het functioneren van deze patiënten verbetert. Enkele onderzoeken ondersteunen deze hypothese en vinden dat CPAP behandeling leidt tot beter neurologisch herstel (Tomfohr et al. 2012)33. Tot op heden hebben studies echter nog geen verbetering van het cognitief functioneren van CVA-patiënten met slaapapneu kunnen aantonen.
Ondanks dat slaapapneu veel voorkomt bij CVA-patiënten en een negatieve invloed lijkt te hebben op het herstel van deze patiënten, wordt slaapapneu vaak niet gediagnosticeerd en blijft onbehandeld. Dit is de reden dat in 2010 in revalidatiecentrum Heliomare een onderzoek naar slaapapneu bij CVA-patiënten gestart is. Het eerste doel van het onderzoek was het verbeteren van de vroege herkenning van slaapapneu bij CVA-patiënten tijdens hun opname in een revalidatiecentrum. Het tweede doel was het onderzoeken van de effecten van slaapapneu op verschillende aspecten van het dagelijks functioneren, waaronder het cognitief functioneren van CVA-patiënten tijdens hun opname. Het laatste doel was evalueren of behandeling met CPAP het herstel in (cognitief) functioneren van CVA-patiënten tijdens hun revalidatie bevordert.
Vroege herkenning van slaapapneu bij CVA-patiënten
Uit een enquête bij Nederlandse revalidatiecentra bleek dat weinig centra onderzoek doen naar slaapapneu bij (opgenomen) CVA-patiënten. Het uitvoeren van een uitgebreide slaapregistratie is in revalidatiecentra vaak niet haalbaar vanwege beperkte beschikbaarheid van apparatuur en hoge kosten. In dit kader hebben wij een getrapte diagnostische benadering onderzocht, waarbij patiënten slechts het onderzoek krijgen dat nodig is. Voor deze benadering zijn betrouwbare en makkelijk te gebruiken screeningsinstrumenten een vereiste. Er zijn twee studies uitgevoerd met als doel de voorspellende waarde en bruikbaarheid van twee verschillende screeningsmethoden voor het opsporen van slaapapneu te onderzoeken.
De eerste onderzochte screeningsmethode is pulse-oximetrie (Aaronson et al., 2012)2. Zoals eerder beschreven kan met deze methode het aantal zuurstofdalingen in het bloed per uur (oxygen desaturation index=ODI) worden berekend. Deze methode wordt veel gebruikt in algemene slaapklinieken, maar was nog niet onderzocht in de CVA-populatie. In deze eerste studie kregen 56 CVA-patiënten zowel een pulse-oximetrie onderzoek als een uitgebreide slaapregistratie middels polygrafie. Bij 46% van de patiënten werd de diagnose slaapapneu vastgesteld. De meerderheid van de patiënten met slaapapneu was man, ouder (59.9 jaar; sd=7.4) en had een hogere body mass index (BMI van 27.2; sd=4.6)) dan de patiënten zonder slaapapneu (leeftijd, 51.9; sd=11.1; BMI, 24.2; sd=4.6).
Met behulp van pulse-oximetrie kon met 93% diagnostische nauwkeurigheid onderscheid gemaakt worden tussen de patiënten met en zonder slaapapneu. De sensitiviteit en specificiteit waren respectievelijk 77 en 100%. De sensitiviteit geeft de gevoeligheid van de test om patiënten met slaapapneu op te sporen aan, terwijl de specificiteit het percentage mensen is bij wie die diagnose terecht niet wordt gesteld. Gezien de hoge prevalentie van slaapapneu in deze groep CVA-patiënten, gaf een positieve uitkomst op pulse-oximetrie (ODI≥15) een 100% waarschijnlijkheid op slaapapneu, terwijl de waarschijnlijkheid op slaapapneu bij een negatief resultaat tot 17% daalde. Er werden geen klinische variabelen gevonden die een verdere verbetering gaven van de voorspellende waarde van pulse-oximetrie. Op basis van de hoge voorspellende waarde van pulseoximetrie werd geconcludeerd dat het een goede screeningsmethode is voor slaapapneu bij CVA-patiënten tijdens de revalidatie.
Als vervolg is in een tweede studie gekeken of een nog simpeler en goedkopere methode, een screeningsvragenlijst, kan dienen als een bruikbare eerste stap in de getrapte diagnostische benadering (Aaronson et al., 2014)4. Uit eerder onderzoek bleek dat veel gebruikte en goed gevalideerde screeningsvragenlijsten zoals de Berlin Questionnaire, niet geschikt zijn voor de CVA-populatie (Kotzian et al., 2012)23. Bij gebrek aan een geschikte vragenlijst voor CVA-patiënten hebben wij zelf een vragenlijst ontwikkeld. De vragenlijst bestond uit drie delen: subjectieve klachten, sociodemografische kenmerken en klinische gegevens. Het subjectieve klachtendeel bestond uit elf vragen over snurken, ademstilstanden tijdens de slaap, slaperigheid, vermoeidheid overdag, in slaap vallen overdag, niet uitgerust wakker worden, hoofdpijn bij het wakker worden, concentratieverlies, rusteloze benen, prikkelbaarheid en stemmingswisselingen. De vragen werden als volgt gesteld: ‘Heeft u last van ….?’ en konden met ‘ja’ of ‘nee’ beantwoord worden. De sociodemografische kenmerken die gevraagd werden, waren geslacht, leeftijd en burgerlijke staat. De klinische gegevens werden verkregen uit het medisch dossier en bestonden uit: BMI, bloeddruk, type en lokalisatie van het CVA, comorbiditeiten, roken en medicatie.
Deze vragenlijst is bij 438 CVA- patiënten afgenomen (Aaronson et al., 2015)1. Daarnaast is er met behulp van pulse-oximetrie vastgesteld welke patiënten een hoge waarschijnlijkheid van slaapapneu hadden (ODI≥15). In deze grotere studiepopulatie had 31% van de CVA-patiënten een hoge waarschijnlijkheid van slaapapneu. Op basis van de vragenlijst werd gevonden dat de volgende variabelen voorspellend waren en deze werden opgenomen in het uiteindelijke predictiemodel: mannelijk geslacht, hogere leeftijd, hogere BMI, en zelfgerapporteerde klachten van ademstilstanden tijdens de slaap en overdag in slaap vallen. Het opgestelde predictiemodel had een diagnostische nauwkeurigheid van 76%, met een sensitiviteit en specificiteit van respectievelijk 72 en 69%. Bij een negatieve uitslag daalde de kans op slaapapneu tot 15%, terwijl bij een positieve uitslag de kans 50% was. De vragen uit het predictiemodel kunnen derhalve goed gebruikt worden als eerste screeningsmethode, omdat deze methode het aantal CVA-patiënten dat uitgebreidere slaapapneu-screening nodig heeft significant vermindert. Vervolgens kan in de geselecteerde groep patiënten de tweede stap uit de getrapte diagnostische benadering, pulse-oximetrie, worden uitgevoerd om te bepalen wie werkelijk een hoog risico op slaapapneu heeft.
Gevolgen slaapapneu voor het revalidatietraject van CVA-patiënten
Voor het tweede doel van het onderzoek, het vaststellen van het effect van slaapapneu (specifiek OSA) op het (cognitief) functioneren van CVA-patiënten, is tussen 2011 en 2014 gecontroleerd onderzoek gedaan bij patiënten op de klinische CVA-afdeling van Heliomare (Aaronson et al., 2015). CVA-patiënten werd gevraagd aan het onderzoek deel te nemen als ze tussen de 18 en 85 jaar waren en opgenomen waren tussen de een en zestien weken na het doormaken van het CVA. Redenen voor exclusie waren traumatisch hersenletsel, ernstige afasie, ernstige medische of psychiatrische comorbi diteiten en CSA of eerder behandelde slaapapneu. Patiënten ondergingen slaaponderzoek middels pulseoximetrie en polygrafie om de aanwezigheid van slaapapneu vast te stellen.
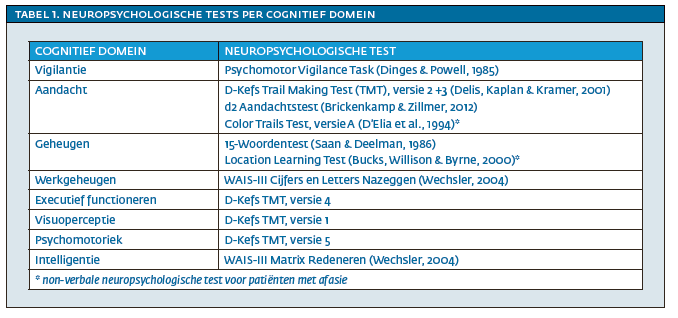
De primaire uitkomstmaten van het onderzoek waren cognitieve en functionele status. Het cognitief functioneren werd binnen vier weken na opname gemeten aan de hand van een batterij van veel gebruikte neuropsychologische tests. De volgende negen cognitieve domeinen werden gemeten: vigilantie, aandacht, geheugen, werkgeheugen, executief functioneren, taal, visuoperceptie, psychomotoriek en intelligentie. Binnen een aantal cognitieve domeinen is gebruik gemaakt van non-verbale testen voor patiënten met afasie.
In Tabel 1 staat een overzicht van de neuropsychologische testen per cognitief domein. De testscores werden omgezet in z-scores op basis van normatieve waarden. Deze scores zijn gecorrigeerd voor leeftijd en opleiding en vervolgens gemiddeld tot domeinscores.
De functionele status werd op de eerste dag van opname vastgesteld door de revalidatiearts met behulp van twee schalen voor neurologische status (Canadian Neurological Scale; Cote et al., 1989 en National Institutes of Health Stroke Scale; Goldstein, Bertels & Davis, 1989)1118 en een schaal voor dagelijks functioneren (ADI; Utrechtse Schaal voor Evaluatie van Revalidatie; Post et al., 2009))28. De schalen voor neurologische status bestonden uit vragen over onder andere verlammingsverschijnselen, verminderde spierkracht, aansturingsproblemen en gezichtsvelddefecten, waarop de revalidatiearts kon aangeven of er ‘geen’, ‘in lichte mate’ of ‘in ernstige mate’ sprake was van deze problemen. De ADI-schaal was gericht op de mate van zelfverzorging (onder meer eten en drinken, persoonlijke verzorging, aankleden, douchen, en toiletgang) en mobiliteit (zoals zitten, staan, opstaan, lopen of rolstoelrijden). Per onderdeel kon worden aangegeven of de bezigheid ‘grotendeels of volledig door anderen’, ‘onder toezicht en/of met hulp’, ‘met moeite, met hulpmiddel’, ‘met moeite, zonder hulpmiddel’, ‘zonder moeite, met hulpmiddel’ of ‘zonder moeite, zonder hulpmiddel’ werd uitgevoerd. De behaalde scores op beide schalen werden op basis van gemiddelde en standaarddeviatie van de groep omgezet naar z-scores voor neurologische status en ADI. Naast de primaire uitkomstmaten zijn ook maten voor slaperigheid (Stanford Sleepiness Scale; Herscovitch & Broughton, 1981)19, vermoeidheid (Checklist Individual Strength; Vercoulen et al., 1994)35, angst en depressie (Hospital Anxiety and Depression Scale; Zigmond & Snaith, 1983)42, en subjectieve slaapkwaliteit (Sleep Quality Scale; Visser, Hofman & Kumar, 1979)36 meegenomen in het onderzoek.
Na screening bleken 449 van de 654 patiënten geschikt, van wie uiteindelijk 180 patiënten aan het volledige onderzoek hebben deelgenomen. Belangrijkste redenen voor uitval waren ontslag uit het revalidatiecentrum voor de start van de studie (n=121) en het niet willen deelnemen aan de studie (n=122). Van de 180 patiënten hadden 80 patiënten matig tot ernstig slaapapneu (AHI≥15), 33 patiënten milde slaapapneu (AHI=5-15) en 67 patiënten geen sleepapneu (AHI<5).
Voor de analyses is gekozen om de groep met matig tot ernstig slaapapneu te vergelijken met de patiënten zonder slaapapneu, en de groep met lichte slaapapneu uit te sluiten (n=33). De uiteindelijke studiegroep bestond dus uit 147 patiënten. De gemiddelde leeftijd van deze patiënten was 57.8 jaar (sd=10.1). Ongeveer een derde van de patiënten had overgewicht (BMI 25-30) en bij 15% van de patiënten was er sprake van obesitas (BMI >30). Het grootste deel van de patiënten had een eerste CVA doorgemaakt (83%), waarbij er bij 71%van de patiënten sprake was van een herseninfarct en bij 29% van een hersenbloeding. De gemiddelde opnameduur van patiënten op de CVA-afdeling was 69 dagen (sd= 33). De groep met slaapapneu was significant ouder (60.4 jaar; sd=8.5) dan de groep zonder slaapapneu (54.9 jaar; sd=10.1) en had een significant hogere BMI (27.1; sd=5.0 versus 23.9; sd=3.6). Er waren geen verschillen tussen de groepen op andere demografische en klinische gegevens zoals geslacht, opleidingsniveau en type of ernst van CVA.
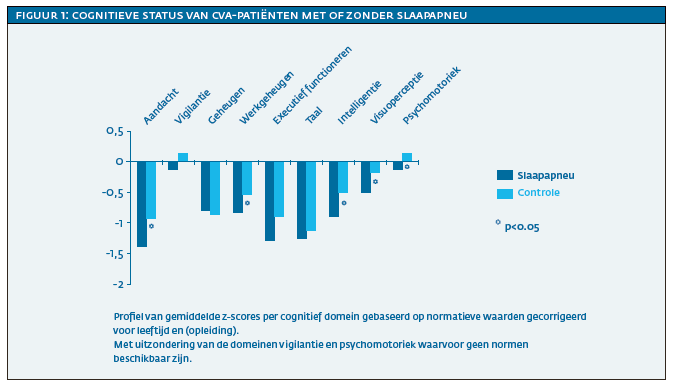
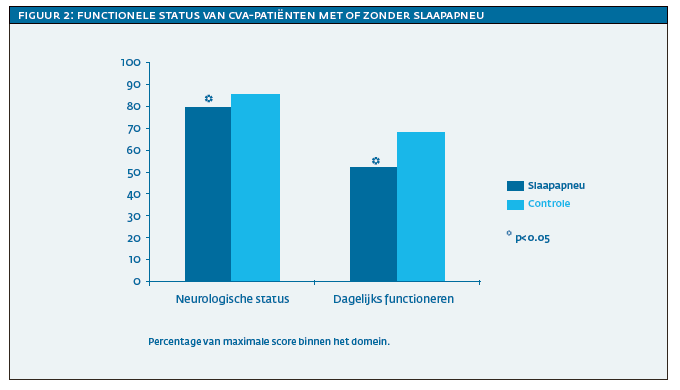
De belangrijkste bevindingen uit het onderzoek waren dat patiënten met slaapapneu meer beperkingen hadden in zowel de cognitieve als de functionele status. De groep met slaapapneu had meer cognitieve beperkingen in de domeinen van aandacht, executief functioneren, visuoperceptie, motorische snelheid en intelligentie (zie figuur 1), terwijl er geen verschil was in de domeinen vigilantie, geheugen, werkgeheugen en taal. Er was sprake van een slechtere neurologische status en een hogere mate van afhankelijkheid in het dagelijks functioneren in de domeinen zelfverzorging en mobiliteit (zie figuur 2). Daarnaast waren patiënten met slaapapneu gemiddeld elf dagen langer opgenomen in Heliomare dan patiënten zonder slaapapneu. Er waren geen verschillen tussen patiënten met en zonder slaapapneu op zelfgerapporteerde slaperigheid, vermoeidheid, slaapkwaliteit en symptomen van angst- en depressie.
Samenvattend: slaapapneu is geassocieerd met beperkingen in het (cognitief) functioneren van CVA-patiënten tijdens hun revalidatietraject. Deze bevinding was aanleiding te onderzoeken of behandeling van de slaapapneu deze beperkingen kan verminderen. Het laatste doel van ons onderzoek was dan ook het evalueren van het effect van CPAP-behandeling op het (cognitief) functioneren van CVA-patiënten.
Effect CPAP-behandeling op cognitief functioneren
In voorbereiding op dit onderzoek is eerst een meta-analyse gedaan naar het effect van CPAP in de algemene slaapapneupopulatie (Kylstra et al., 2013)24. Eerdere reviews suggereerden dat CPAP het cognitief functioneren in verschillende domeinen, zoals vigilantie, aandacht en geheugen, verbetert (Aloia et al., 2004; Weaver & Chasens, 2007). Deze reviews waren echter kwalitatief van aard, waardoor de grootte van de gevonden effecten onduidelijk bleef.
In de meta-analyse zijn uiteindelijk dertien gerandomiseerde, gecontroleerde onderzoeken meegenomen. De voornaamste bevinding was dat er slechts een klein positief effect van CPAP was op de aandachtfunctie, terwijl er geen verbetering werd gevonden in andere cognitieve domeinen zoals het geheugen en vigilantie. Meer specifiek werd een verbetering gezien in de verdeelde aandacht, waarbij taken die meer inspanning vereisten een grotere verbetering gaven (Trail Making Test (versie B) en Paced Auditory Serial Addition Task). Daarnaast is in deze geselecteerde groep studies gekeken of er sprake was van een vermindering van slaperigheid en een verbetering van de stemming. Er werd een verbetering gevonden van zowel objectieve en subjectieve slaperigheid als stemming. De gevonden verbeteringen op het gebied van slaperigheid en stemming kwamen overeen met de resultaten uit een eerder uitgevoerde meta-analyse (Giles et al., 2006).
Hoewel op basis van onze meta-analyse in de algemene slaapapneu-populatie slechts minimale verbetering van het cognitief functioneren verwacht kan worden, is meer onderzoek nodig om de invloed van de ernst van slaapapneu, behandelduur en therapietrouw op dit effect vast te stellen.
Effect CPAP-behandeling op revalidatie CVA-patiënten
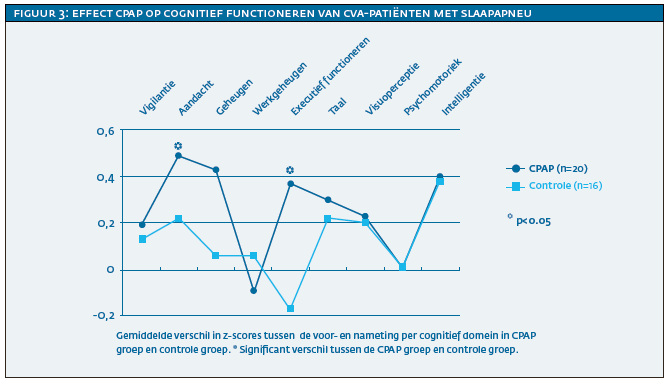
Om het effect van CPAP-behandeling op het functioneren van CVA-patiënten tijdens de revalidatie te onderzoeken is een gerandomiseerde, gecontroleerde studie uitgevoerd waarbij vier weken standaard revalidatiebehandeling vergeleken is met vier weken CPAP-behandeling (Aaronson et al., 2016)3. Voor deelname aan het onderzoek zijn de tachtig CVA-patiënten met OSA benaderd die hadden deelgenomen aan de metingen van cognitieve en functionele status. Van hen waren 36 bereid deel te nemen; zij werden willekeurig over de CPAP-behandeling (n=20) en standaardbehandeling (controlegroep; n=16) verdeeld. Als primaire uitkomstmaten zijn de metingen van de hierboven beschreven functionele status en cognitieve status voor en na de interventieperiode afgenomen. Slaperigheid, vermoeidheid, slaapkwaliteit en stemming waren secundaire uitkomstmaten.
Patiënten in de CPAP-behandelgroep werden begeleid door een gespecialiseerd ‘Respicare’-team bestaande uit revalidatieartsen en gespecialiseerde verpleegkundigen. Bij de start van de behandeling kregen de patiënten uitgebreide uitleg over de behandeling. Indien mogelijk werd hierbij ook een partner of familielid betrokken. Ter gewenning werd eerst met patiënten overdag geoefend met het dragen van het CPAP-masker. Binnen de eerste week werd de behandeling samen met de patiënt geëvalueerd en gekeken of er aanpassingen aan het masker nodig waren om het comfort te verhogen. Daarnaast werd middels pulse-oximetrie onderzocht of het CPAP-gebruik de slaapapneu voldoende verminderde (ODI <5) en werden, indien nodig, de instellingen van de CPAP aangepast. Het CPAP-apparaat was uitgerust met een geheugenkaart om de therapietrouw te registreren. Het Respicare-team hield tijdens de behandeling regelmatig contact met patiënten om therapietrouw te stimuleren en problemen vroeg te herkennen.
Ondanks de intensieve begeleiding van het Respicareteam was de therapietrouw in de CPAP-groep gemiddeld slechts 2.5 uur per nacht (sd=2.8, 0-9 uur per nacht). Negen patiënten waren niet therapietrouw ( <1 uur per nacht), vier patiënten waren matig therapietrouw (1-4 uur per nacht) en zeven patiënten lieten goede therapietrouw zien ( >4 uur per nacht). Bij de start van de studie werden geen verschillen gevonden tussen patiënten in de CPAP-groep en controlegroep op klinische karakteristieken, functionele en cognitieve status of een van de secundaire uitkomstmaten.
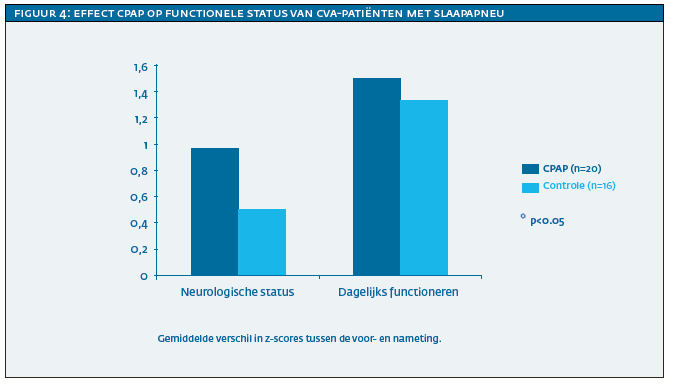
Na de interventieperiode van vier weken lieten de patiënten die CPAP-behandeling hadden gekregen meer verbetering zien in het cognitief functioneren (zie figuur 3) dan de groep die de standaard revalidatiebehandeling kreeg. De cognitieve domeinen waarin verbetering ten opzichte van de controlegroep werd gezien waren aandacht en executief functioneren. De gevonden behandeleffecten waren medium tot groot, wat impliceert dat deze niet alleen statistisch significant waren, maar ook klinisch relevant. De functionele status verbeterde niet (zie figuur 4). Ook voor slaperigheid, vermoeidheid, slaapkwaliteit of stemming waren er geen verschillen tussen de groepen. De CPAP-compliance was met gemiddeld 2,5 uur per nacht laag. Het is daarom mogelijk dat deze lage therapietrouw geleid heeft tot een onderschatting van het werkelijke effect van CPAP.
Conclusie: CPAP heef een positief effect op het cognitieve herstel van CVA-patiënten en CPAP-behandeling heeft een toegevoegde waarde op de standaard revalidatiebehandeling van CVA-patiënten.
Conclusies en aanbevelingen
Het eerste doel van het onderzoek was het verbeteren van de vroege herkenning van slaapapneu bij CVA-patiënten tijdens hun opname in een revalidatiecentrum. Dit deel van het onderzoek heeft twee screeningsinstrumenten opgeleverd die ingezet kunnen worden in een getrapte diagnostische benadering. Deze benadering heeft een drietal voordelen voor het gebruik in de klinische praktijk. Allereerst kan op basis van een beperkt aantal vragen een eerste selectie gemaakt worden van patiënten die verdere slaapapneuscreening nodig hebben. Daarnaast blijkt pulse-oximetrie, de tweede diagnostische stap in de getrapte benadering, een zeer betrouwbare voorspeller te zijn voor slaapapneu in de CVA-populatie. Pulse-oximetrie wordt goed geaccepteerd door patiënten en is goedkoper dan poly(somno)grafie.
Het tweede doel van het onderzoek was meer inzicht te krijgen in de effecten van slaapapneu op het dagelijks functioneren van CVA-patiënten tijdens hun revalidatieopname. We vonden dat slaapapneu geassocieerd is met aanzienlijke beperkingen in het dagelijks functioneren van CVA-patiënten op zowel cognitief als functioneel vlak bij de start van hun revalidatietraject.
Daarnaast heeft het onderzoek laten zien dat CPAP- behandeling een positief effect heeft op het cognitief functioneren van CVA-patiënten. Er kon echter geen verbetering worden aangetoond in de overige domeinen van dagelijks functioneren.
De klinische implicatie van onze resultaten is dat men in de revalidatie bedacht moet zijn op slaapapneu bij CVA-patiënten. Slaapapneu komt immers veel voor en speelt een belemmerende rol bij het herstel. Daarnaast kan adequate CPAP-behandeling bijdragen aan het herstel van deze patiënten.
De lage therapietrouw van CPAP-behandeling bij CVA- patiënten blijft echter een punt van zorg. Onze aanbeveling is daarom om toekomstig onderzoek enerzijds te richten op het ontwikkelen van methoden om de therapietrouw te verbeteren en anderzijds om de bruikbaarheid en effectiviteit van alternatieve, minder belastende behandelvormen zoals positionele therapie te evalueren.
Tot slot: slaapapneu komt niet alleen in de CVA-populatie veel voor, ook in de algemene populatie is slaapapneu na slapeloosheid de meest voorkomende slaapstoornis. Er wordt verwacht dat de prevalentie van apneu in de komende jaren alleen maar verder zal stijgen door de vergrijzing en toename van overgewicht. Het is daarom van belang om ook bij andere doelgroepen bij klachten van vermoeidheid, slaperigheid, vergeetachtigheid en verminderde concentratie altijd bedacht te zijn op slaapapneu, aangezien het een goed behandelbare aandoening is.
Het werk beschreven in dit artikel maakte deel uit van het promotietraject van Aaronson. Het onderzoek is tussen 2010 en 2015 uitgevoerd bij Heliomare Research & Development te Wijk aan Zee in samenwerking met de afdeling Brein en Cognitie van de Universiteit van Amsterdam. Schmand en Van Bennekom waren als promotores betrokken bij het onderzoek, Hofman als co-promotor.