Repetitieve Transcraniële Magnetische Stimulatie (TMS) is een niet-invasieve vorm van hersenstimulatie die in de afgelopen decennia steeds vaker wordt ingezet bij de behandeling van psychiatrische en neurologische aandoeningen. Voor psychologen is het van belang om goed geïnformeerd te zijn over TMS, aangezien deze behandeling steeds vaker wordt ingezet en inmiddels is opgenomen in diverse richtlijnen en zorgstandaarden en ook door psychologen zelf kan worden uitgevoerd.
Dr. Iris van Oostrom, dr. Maarten Laroy, prof. dr. Teresa Schuhmann, dr. Philip van Eijndhoven, prof. dr. Koen Schruers, drs. Lianneke Egberink & dr. Eva Dijkstra
Repetitieve Transcraniële Magnetische Stimulatie (TMS) is een niet-invasieve vorm van hersenstimulatie die in de afgelopen decennia steeds vaker wordt ingezet bij de behandeling van psychiatrische en neurologische aandoeningen. De techniek is met name effectief gebleken bij therapieresistente depressie (Chen et al., 2025; Trapp et al., 2025), maar wordt ook succesvol toegepast bij obsessieve-compulsieve stoornis (OCS). TMS wordt onderzocht voor verschillende andere psychische stoornissen, zoals posttraumatische stressstoornis (PTSS) en voor diverse neurologische aandoeningen (Lefaucheur et al., 2020). Voor psychologen is het van toenemend belang om goed geïnformeerd te zijn over TMS, aangezien deze behandeling steeds vaker wordt ingezet en inmiddels is opgenomen in diverse richtlijnen en zorgstandaarden en ook door psychologen kan worden uitgevoerd. In dit artikel worden de mogelijkheden en de beperkingen van deze behandelvorm uiteengezet, zodat u weet wanneer en voor wie deze behandeling passend is en door wie de behandeling kan worden uitgevoerd.
Wat is TMS?
Tijdens een TMS behandeling wordt een elektromagnetische spoel op een specifieke locatie op het hoofd geplaatst (zie Figuur 1). Deze spoel genereert kortdurende magnetische pulsen die een elektromagnetisch veld opwekken. Dit veld dringt moeiteloos door de schedel heen en beïnvloedt lokaal de activiteit van elektrisch geladen neuronen in de hersenschors. Wanneer het elektromagnetisch veld sterk genoeg is, kunnen de neuronen die lokaal worden gestimuleerd depolariseren, wat leidt tot verandering in hun activiteit. Inmiddels is duidelijk dat TMS niet alleen invloed uitoefent op het direct gestimuleerde hersengebied, maar ook op bredere, onderliggende netwerken waarmee dit gebied functioneel verbonden is (Pascual-Leone et al., 2000).
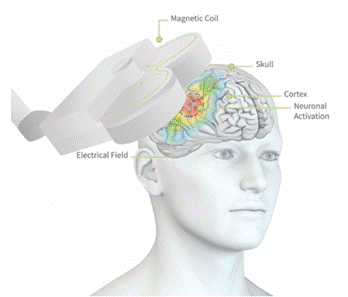
Tijdens een TMS sessie wordt herhaald gestimuleerd, dus met meerdere pulsen achter elkaar. De stimulatieduur is meestal tussen de 20 tot 45 minuten, afhankelijk van het TMS-protocol dat wordt gebruikt. De pulsen kunnen in verschillende frequenties en in verschillende patronen worden aangeboden. Ook kan de specifieke hersenlocatie en de intensiteit waarop wordt gestimuleerd verschillen. Een volledige TMS behandeling beslaat altijd meerdere TMS sessies, die meestal in korte tijd na elkaar plaatsvinden. Door onderzoek weten we steeds beter hoeveel pulsen, in welke frequentie, op welke locatie en in welke intensiteit de TMS aangeboden moet worden om effect te hebben.
Zoals eerder genoemd, is TMS een niet-invasieve vorm van hersenstimulatie. Binnen de hersenstimulatie kan grofweg onderscheid worden gemaakt tussen niet-invasieve en invasieve technieken. Tot de niet-invasieve methoden behoren naast TMS ook vormen van transcraniële elektrische stimulatie, zoals transcraniële gelijkstroomstimulatie (tDCS) en transcraniële wisselstroomstimulatie (tACS). Deze technieken beïnvloeden de hersenactiviteit van buitenaf de schedel, zonder dat daarbij sprake is van chirurgische ingrepen. Invasieve vormen van hersenstimulatie vereisen wel een medische ingreep. Voorbeelden hiervan zijn diepe hersenstimulatie (DBS) en nervus vagus stimulatie (VNS). Deze behandelmethoden worden doorgaans ingezet bij ernstige of therapieresistente aandoeningen. In dit artikel ligt de focus op TMS, omdat deze vorm van hersenstimulatie nu het meest wordt toegepast in de klinische praktijk. Op de andere vormen van hersenstimulatie wordt verder niet ingegaan.
Geschiedenis
Halverwege de jaren tachtig van de vorige eeuw slaagde de Britse onderzoeker Anthony Barker erin om middels magnetische stimulatie de motorische schors (motorcortex) te stimuleren en zo een zichtbare beweging in de hand of duim te genereren (Barker et al., 1985). Omdat de representatie van de hand op de motor cortex relatief nabij de schedel ligt, is het over het algemeen makkelijk om dit gebied te stimuleren. In de beginjaren werd transcraniële magnetische stimulatie (TMS) vooral ingezet als onderzoeksinstrument binnen de neurowetenschappen. Onderzoekers hadden toen nog geen geavanceerde beeldvormende technieken tot hun beschikking en konden via hersenstimulatie toch diverse functies van de neocortex bestuderen. Zo ontdekte men dat stimulatie in een lage frequentie zorgde voor inhibitie van de motorcortex (het deel van de hersenen waar bewegingen worden aangestuurd) en dat stimulatie in een hoge frequentie zorgde voor excitatie van de motorcortex.
Op een gegeven moment viel het onderzoekers op dat deelnemers aan hun onderzoek die meerdere pulsen hadden gekregen, stemmingsverbeteringen rapporteerden (Bickford et al., 1987). Daarop is het effect onderzocht van TMS bij mensen met een depressie en eerste onderzoeken toonden gunstige, doch ook wisselende effecten. In de eerste jaren was het nog zoeken naar de juiste aantal pulsen, stimulatiesterkte, aantal sessies en ook naar de exacte positionering van de spoel. TMS kan -in ieder geval in vergelijking met psychotherapie- relatief makkelijk placebo-gecontroleerd worden onderzocht door te stimuleren met een placebospoel of door de spoel in een andere hoek op het hoofd te plaatsen. In een van de eerste meta-analyses uit 2009 werd vastgesteld dat de effectgrootte van de behandeling in de loop der tijd is toegenomen (Schutter, 2009) en werd geconcludeerd dat er sprake is van een robuuste effectgrootte die vergelijkbaar is met die van antidepressiva. In dat jaar werd TMS voor depressie ook goedgekeurd door de Amerikaanse Food and Drug Administration (FDA), waarna het geleidelijk zijn intrede deed in de klinische praktijk. Vanaf dat moment werd er ook toenemend onderzoek gedaan naar TMS, zowel naar de effecten bij depressie als bij andere psychische stoornissen, maar ook bij neurologische aandoeningen en binnen de revalidatiegeneeskunde. In Nederland wordt TMS voor therapieresistente depressie sinds 2017 vergoed vanuit de basisverzekering.
TMS protocollen
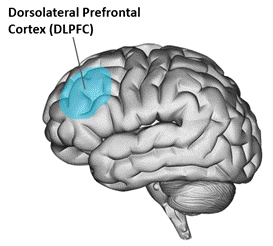
Locatie. TMS behandeling wordt voor de depressieve stoornis vaak gericht op de dorsolaterale prefrontale cortex (DLPFC; zie Figuur 2). Dat is een hersengebied dat onder andere betrokken is bij executieve functies, werkgeheugen en cognitieve controle, maar waarschijnlijk ook een rol heeft bij het reguleren van emoties. Er zijn meerdere methoden om de locatie van stimulatie te bepalen op de schedel. Er kan bijvoorbeeld gewerkt worden met een vastgesteld algoritme (bijvoorbeeld Beam F3; https://clinicalresearcher.org/F3/calculate.php) of met neuronavigatie.
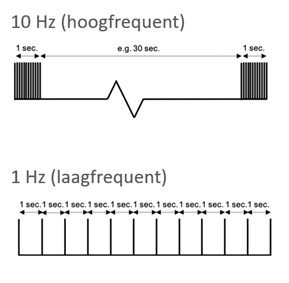
Frequentie. Bij de behandeling van depressie met TMS wordt doorgaans gekozen voor hoogfrequente stimulatie (≥10 Hz) van de linker dorsolaterale prefrontale cortex (DLPFC) of laagfrequente stimulatie (≤1 Hz) van de rechter DLPFC. Deze keuze was oorspronkelijk gebaseerd op de hypothese dat depressie gepaard gaat met een functionele disbalans tussen beide hersenhelften: verminderde activiteit in de linker DLPFC en verhoogde activiteit in de rechter DLPFC. Het idee was dat hoogfrequente stimulatie de hypoactieve linkerzijde zou activeren, terwijl laagfrequente stimulatie de hyperactieve rechterzijde zou remmen. Hoewel beide protocollen effectief zijn gebleken in het verminderen van depressieve symptomen, wordt de onderliggende theorie van hemisferische disbalans tegenwoordig als te simplistisch beschouwd. Recente studies tonen aan dat TMS niet alleen lokale effecten heeft, maar ook invloed uitoefent op bredere neurale netwerken die betrokken zijn bij stemming en cognitie (Tik et al., 2017). In Figuur 3 staan de diverse frequenties uitgelegd.
Een andere vorm van TMS is theta burst stimulatie (TBS). Daarbij wordt gestimuleerd in korte reeksen van 50 Hz. Het idee hierachter is dat dit stimulatiepatroon neuroplasticiteit bevordert, omdat het overeenkomt met hersenactiviteit die optreedt tijdens geheugenprocessen. Dankzij deze protocollen kunnen in korte tijd grote aantallen pulsen worden toegediend, waardoor de behandeling vaak binnen enkele minuten voltooid is.
Duur, dosering en timing van de sessies. De duur van elke sessie is afhankelijk van het aantal pulsen per sessie. Meestal wordt gekozen voor 900 tot 3000 pulsen per sessie. De sterkte van stimulatie wordt afgestemd op het individu door te zoeken naar een sterkte waarbij een lichte beweging van de duim te zien is als reactie op een puls op de motor cortex.
De TMS-sessies moeten herhaaldelijk worden toegediend, met een minimum van twee keer per week. In de praktijk wordt meestal vier tot vijf keer per week behandeld. In de afgelopen jaren is het bovendien steeds gebruikelijker geworden om meerdere sessies per dag aan te bieden. Het voordeel hiervan is dat het effect van de behandeling sneller kan optreden. Een voorbeeld van zo’n intensief schema is het SNT-protocol, waarbij dagelijks tien TBS-sessies worden toegediend (één per uur), gericht op een individueel bepaalde hersenlocatie met behulp van neuronavigatie. Ook andere versnelde protocollen – bijvoorbeeld met drie sessies per dag – zijn effectief gebleken (Ramos et al., 2025; Sonmez et al., 2019).
Aantal sessies. Meestal bestaat een behandeling uit 25-36 sessies. In de klinische praktijk wordt vaak langer doorbehandeld, onder andere omdat gebleken is dat sommige patiënten meer tijd nodig hebben om te herstellen van hun depressie en dat langer doorbehandelen meer respons- en remissie oplevert (Hutton et al., 2023).
Effectiviteit bij depressie
Verschillende meta-analyses en netwerk meta-analyses concluderen dat TMS bij depressie een effectieve behandeling is in vergelijking met placebo (Dalhuisen et al., 2022; Sehatzadeh et al., 2019). De effectgrootte voor verandering in ernst van de depressieve klachten is groot; de effectgrootte voor respons en remissie is medium tot groot (Dalhuisen et al., 2022). Een studie naar de effecten in de klinische praktijk, waarbij gegevens van 5010 patiënten werd geanalyseerd, rapporteert ongeveer 28-62% remissie en 58-83% respons (Sackeim et al., 2020), waarbij de patiënten die meer dan 20 sessies kregen duidelijk een beter effect hadden op hun depressieve klachten. Zowel in de meta-analyses als in de hierboven beschreven studie gaat het om patiënten met therapieresistente depressie, wat meestal wordt gedefinieerd als minstens twee richtlijn-behandelingen met onvoldoende effect. TMS blijkt echter ook effectief te zijn wanneer er nog geen sprake is van therapieresistentie (Voigt et al., 2019). Daarnaast werd in een recente gerandomiseerde vergelijking tussen antidepressieve behandelingen bij therapieresistente depressie gevonden dat TMS effectiever was in het verminderen van depressieve symptomen dan een overstap naar een andere antidepressiva (Dalhuisen et al., 2024).
Hoewel hoogfrequente stimulatie op de linker DLPFC het meest is onderzocht, is stimulatie op de rechter DLPFC even effectief gebleken (Chen et al., 2013; Dalhuisen et al., 2022). Het voordeel van het laagfrequente protocol is dat het beter wordt verdragen door patiënten en goed is te combineren met psychotherapie (Chen et al., 2013). Bilaterale protocollen, waarbij er in één sessie achtereenvolgend zowel laagfrequent rechts als hoogfrequent links wordt gestimuleerd, zijn even effectief als unilaterale protocollen (Aaronson et al., 2022; Chen et al., 2014; Dalhuisen et al., 2022). Omdat bilaterale protocollen meer tijd vragen, maar niet effectiever zijn, heeft het de voorkeur om bij depressie te kiezen voor een van de unilaterale protocollen. In de multidisciplinaire richtlijn depressie wordt geadviseerd om bij voorkeur een hoogfrequent protocol in te zetten, omdat dit protocol in de grootste groepen patiënten is onderzocht (Trapp et al., 2025).
TMS behandeling heeft als voordeel dat het een veilige behandeling is met weinig bijwerkingen, en dat de behandeling goed te combineren is met andere behandelingen zoals psychotherapie en medicatie. Bovendien is de kosteneffectiviteit bij depressie aangetoond (Dalhuisen et al., 2024). TMS behandeling heeft als nadeel dat deze tijdsintensief is; er zijn meestal wel 30 sessies nodig. Bij de depressie met psychotische kenmerken is TMS niet geïndiceerd.
Bipolaire Stoornis. TMS bij bipolaire depressie laat een bescheiden effectiviteit zien. Meta-analyses tonen een kleine verbetering van depressieve symptomen (effectgrootte van 0,31) (Nguyen et al., 2021; Tee & Au, 2020). Andere onderzoeken gaven gemengde en niet doorslaggevende resultaten, vooral met iTBS (Konstantinou et al., 2022; McGirr et al., 2021). Er is weinig bewijs voor de effectiviteit van TMS bij manische symptomen. Het is nog niet duidelijk of er een verhoogd risico is op het ontstaan van een manie of hypomanie tijdens een TMS behandeling; daarom kan preventief behandeld worden met een stemmingstabilisator tijdens de behandeling. Desondanks blijft TMS voor bipolaire stoornis een veelbelovend onderzoeksgebied.
Adolescenten met depressie. Recente meta-analyses suggereren dat rTMS mogelijk op een veilige manier kan worden toegepast bij kinderen en adolescenten met een depressieve stoornis
(Majumder et al., 2021; Qiu et al., 2023; Sigrist et al., 2022). Hoewel TMS in de Verenigde Staten reeds een FDA-erkenning heeft voor gebruik bij adolescenten met therapieresistente depressie, is de evidentie voor effectiviteit nog beperkt. Er zijn tot op heden een beperkt aantal randomized controlled trials uitgevoerd en de grootste dubbelblinde, placebo-gecontroleerde studie (n = 103) vond geen verschil in antidepressieve effecten tussen de actieve en de placebogroep, met vergelijkbare veiligheidsprofielen en geen toename van suïcidaliteit (Croarkin et al., 2021).
Geriatrische depressie. Bij oudere volwassenen biedt TMS een goed te verdragen alternatief voor medicatie, die vaak bijwerkingen of interacties met andere medicatie kan veroorzaken (Knochel et al., 2015). De resultaten zijn echter gemengd, met responspercentages variërend van 6,7% tot 54,3% en remissiepercentages van 8,2% tot 40,0% (Cappon et al., 2022). Factoren zoals medische comorbiditeiten, gelijktijdig medicatiegebruik en leeftijdsgebonden veranderingen in de hersenstructuur kunnen de uitkomsten beïnvloeden. Desondanks suggereren studies een betekenisvolle respons en remissie (Blumberger et al., 2022; Roth et al., 2024). In de multidisciplinaire richtlijn wordt TMS aanbevolen bij ouderen vanwege het milde bijwerkingenprofiel in vergelijking tot medicatie.
Peripartum depressie. Bij peripartumdepressie wordt TMS soms overwogen als een veiliger alternatief voor antidepressiva, omdat medicatiegebruik risico’s kan opleveren voor het kind tijdens de zwangerschap en borstvoeding (Dubovicky et al., 2017). Kleine studies (N = 85 tijdens zwangerschap en N = 49 postpartum) wijzen erop dat TMS zowel effectief als veilig is, zonder nadelige effecten voor moeders of baby’s (Damar et al., 2020; Pridmore et al., 2021). Langetermijnresultaten bij kinderen geboren nadat de moeder werd behandeld met TMS tijdens de zwangerschap, toont een normale cognitieve en motorische ontwikkeling bij het kind (Eryılmaz et al., 2015). Hoewel ECT een bewezen behandeling is voor ernstige peripartumdepressie, vertegenwoordigt TMS een veelbelovend alternatief, vooral bij niet-psychotische depressieve stoornissen.
Effectiviteit bij andere stoornissen
Naast depressie is TMS ook onderzocht voor de behandeling van diverse andere psychische stoornissen, zoals voor obsessieve-compulsieve stoornis (OCS), Posttraumatische stressstoornis (PTSS), neuropathische pijn, migraine, aan middelen gerelateerde stoornissen, dissociatie- en psychotische stoornissen. TMS wordt ook toenemend onderzocht binnen de revalidatie, bijvoorbeeld om het herstel van neglect of motorische of taalstoornissen te ondersteunen na een cerebrovasculair accident (CVA) (zie voor een uitgebreid overzicht van de literatuur t/m 2018 (Lefaucheur et al., 2020).
PTSS. Uit recentere meta-analyses komt naar voren dat TMS effectief is voor PTSS, met een grote effectgrootte (Cirillo et al., 2019; Kan et al., 2020), waarbij met name hoogfrequente stimulatie van de rechter DLPFC effectief lijkt te zijn (Harris & Reece, 2021; Kan et al., 2020). Het therapeutische effect bleef stabiel in de follow-up metingen, die varieerden van twee weken tot een jaar na behandeling (Petrosino et al., 2021).
OCS. Recente meta-analyses naar de effectiviteit van TMS bij OCS toonde een significante vermindering van de symptoom-ernst aan na behandeling met actieve TMS vergeleken met placebo (Joseph et al., 2025; Rehn et al., 2018; Thatikonda et al., 2023), met matige tot grote behandeleffecten. Bij de behandeling van OCS kunnen drie verschillende stimulatielocaties worden overwogen: De DLPFC, de pre-supplementaire motorische area (SMA) en de orbitofrontale cortex, gezien hun bewezen effectiviteit. Op basis van netwerk-meta-analyses is echter niet duidelijk welk TMS-protocol van die drie het meest effectief is voor OCS (Fitzsimmons et al., 2022).
Stoornis in gebruik van middelen. Meta-analyses laten zien dat TMS een positief effect heeft op craving en abstinentie van middelen, maar dit effect is tot op heden duidelijker aangetoond bij mensen met een stoornis in het gebruik van stimulerende middelen dan bij het gebruik van dempende middelen (Gay et al., 2022; Mostafavi et al., 2020; Zhang et al., 2019).
Veiligheid van TMS
TMS wordt over het algemeen beschouwd als een veilige en goed verdraagbare behandeling. De meest voorkomende bijwerkingen zijn spanningshoofdpijn (28–65%), misselijkheid (7–11%), duizeligheid (4–9%), vermoeidheid (7–8%) en slapeloosheid (5–7%), die allemaal acuut en van beperkte duur zijn (Trapp et al., 2025). Zeldzame bijwerkingen, zoals epileptische aanvallen, komen zeer weinig voor (minder dan 0,1% bij standaard TMS-protocollen en ongeveer 0,003% in sommige studies) (Rossi et al., 2009). Hypomane of manische symptomen kunnen optreden, met name bij patiënten met een bipolaire stoornis, maar deze incidentie is vergelijkbaar met placebo-behandelingen (Xia et al., 2008). Veiligheidsmaatregelen, waaronder grondige pre-TMS-evaluatie en monitoring tijdens de behandeling, helpen de risico’s te beperken (Rossi et al., 2021).
Onderzoek toont ook aan dat TMS geen significante cognitieve bijwerkingen veroorzaakt en juist het cognitief functioneren kan verbeteren (Ilieva et al., 2018; Martin et al., 2017). Bij patiënten met depressie is TMS uitgebreid onderzocht, en studies wijzen erop dat het zelfs kan leiden tot verbeteringen in cognitieve functies (Kaster et al., 2018; Yildiz et al., 2023). Een systematische review van onderzoeken bij depressieve patiënten liet zien dat TMS, vooral gericht op de DLPFC, niet alleen effectief is in het verminderen van depressieve symptomen, maar ook gepaard gaat met verbeteringen in geheugen, aandacht en executieve functies (Lefaucheur et al., 2020).
TMS in richtlijnen en zorgstandaarden
In 2024 is de nieuwe multidisciplinaire richtlijn depressie uitgekomen. In de richtlijn wordt geadviseerd om TMS in te zetten wanneer twee eerdere behandelstappen tot onvoldoende resultaat hebben geleid (zie Figuur 4). Wanneer medicatie slecht wordt verdragen kan TMS ook al eerder worden ingezet. In de nieuwe multidisciplinaire richtlijn angst en dwang (2024) wordt geadviseerd TMS behandeling te overwegen bij een dwangstoornis wanneer een of meerdere richtlijnbehandelingen onvoldoende effect hebben gehad. Geadviseerd wordt om TMS zo veel mogelijk te combineren met CGT. Ook in de zorgstandaarden dissociatieve stoornissen en psychotische stoornissen wordt geadviseerd dat TMS behandeling overwogen kan worden wanneer eerdere behandelstappen onvoldoende effect hebben gehad.
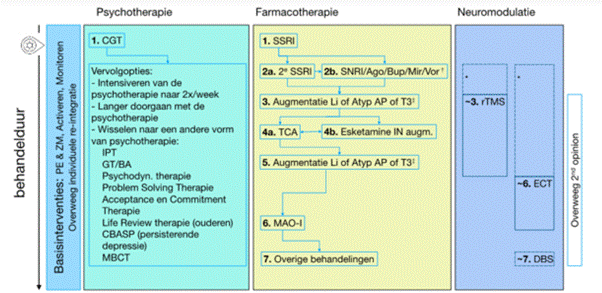
Afkortingen: Ago= agomelatine; Atyp AP=atypische antipsychotica; BA= behavioral activation; Bup= buproprion; CBASP= cogitive behavioral analysis system of psychotherapy; CGT=cognitieve gedragstherapie; DBS= deep brain stimulation; ECT= electroconvulsie therapie; GT= gedragstherapie; IN= intranasaal; IPT= interpersoonlijke therapie; Li= lithium; MAO-I= Monoamine Oxidase inhibitor; MBCT= Mindfulness-based cognitieve therapie; Mir= mirtazapine; TMS= repetitieve Transcraniele magnetische stimulatie; SNRI= serotonine noradrenaline reuptake inhibitor; SSRI= selectieve serotonine reuptake inhibitor; T3= schildklierhormoon; TCA= tricyclisch antidepressivum; Vor= vortioxetine
Combinatie met psychologische behandeling
Voor, tijdens en na de hersenstimulatie kunnen verschillende psychotherapeutische interventies worden aangeboden. Dit is tijdsefficiënt voor de patiënt en er is mogelijk ook sprake van een synergistisch effect waarbij de TMS het effect van de interventies kan versterken. Bij depressie kunnen cognitief gedragstherapeutische technieken worden ingezet tijdens de stimulatie, zoals psycho-educatie, reactivatie, cognitieve therapie, het opzetten van gedragsexperimenten, imaginatie met rescripting en terugvalpreventie. Voor stoornissen waarvoor een vorm van exposure aangewezen is, zoals angst- en dwangstoornissen en PTSS, kan de exposure op verschillende manieren worden gecombineerd met de TMS behandeling.
Verschillende onderzoeken suggereren dat de combinatie van TMS en psychotherapie, zoals cognitieve gedragstherapie, effectiever is dan beide behandelingen afzonderlijk. Zo bleek uit een Nederlands onderzoek onder 196 patiënten met therapieresistente depressie dat 66% van de patiënten positief reageerde op de combinatiebehandeling, met een remissiepercentage van 56% (Donse et al., 2018). Deze resultaten liggen hoger dan de uitkomsten van de meeste onderzoeken naar alleen TMS, wat suggereert dat de combinatiebehandeling effectiever is. Hierbij moet wel opgemerkt worden dat er geen gerandomiseerd onderzoek is gedaan waarin TMS met en zonder CGT rechtstreeks zijn vergeleken.
Huidige stand van zaken in Nederland
TMS behandeling bij depressie is in meerdere studies kosteneffectief gebleken (Dalhuisen et al., 2024). Dat is een van de redenen dat de zorgverzekeraars TMS bij therapieresistente depressie vergoeden sinds 2017. Daarbij dient TMS behandeling gecombineerd te worden met cognitieve gedragstherapie. Momenteel wordt in Nederland onder andere onderzoek gedaan naar de (kosten) effectiviteit bij dwang (TETRO-onderzoek) en bipolaire stoornis (T-BIDE); ook wordt een versnelde behandelvorm onderzocht bij depressie (DDOT). In de revalidatie wordt onderzocht of TMS het herstel van de hand-armfunctie na een beroerte kan bespoedigen (B-STARS2).
TMS behandeling kan worden uitgevoerd door basispsychologen, gezondheidszorgpsychologen, klinisch (neuro)psychologen, psychiaters en behandelaren met een relevante HBO-opleiding zoals verpleegkunde. Omdat TMS-behandeling effectief is gebleken en goed te combineren is met psychologische behandeling, is het een interventie die ook voor psychologen aantrekkelijk is om aan te bieden. Een TMS-opleiding beslaat ongeveer twee dagen aan onderwijs en daarna een ‘hands-on’ praktijkdeel, waarbij nog enige tijd moet worden gewerkt onder supervisie. De kwaliteit van TMS-behandeling wordt in Nederland geborgd door een accreditatie-register door de Stichting Hersenstimulatie (website). BIG-geregistreerde behandelaren kunnen worden opgeleid tot TMS-professionals en hebben een indicerende en uitvoerende rol. Niet-BIG-geregistreerde behandelaren kunnen worden opgeleid tot TMS technician.
Nieuwe ontwikkelingen
Er wordt veel onderzoek gedaan naar niet-invasieve hersenstimulatie en er zijn continu nieuwe ontwikkelingen. Verschillende onderzoekers werken momenteel aan het vinden van betere behandellocaties voor psychische stoornissen of voor specifieke symptoomclusters zoals angst, depressie, pijn en emotieregulatie (Siddiqi et al., 2024). Op basis van laesie studies en stimulatiestudies (o.a. met DBS) in grote groepen patiënten wordt onderzocht in welke hersennetwerken specifieke laesies en stimulatielocaties een rol hebben. Daarna kan het verband gelegd worden tussen de specifieke hersennetwerken en symptoomclusters of psychische stoornissen. Voor onderzoek is dit interessant, omdat zo causale relaties tussen hersennetwerken en symptoomclusters onderzocht kunnen worden. Voor de klinische praktijk is dit relevant, omdat op deze wijze mogelijk betere en preciezere behandellocaties gevonden kunnen worden voor TMS behandeling. Op basis van de belangrijkste klachten van de patiënt en de beschikbare evidentie kan in de toekomst mogelijk gerichter worden bepaald welke hersenregio gestimuleerd moet worden.
Een andere nieuwe ontwikkeling is bijvoorbeeld Heart-Brain Coupling (HBC) TMS, een methode waarbij de daling van de hartslag tijdens TMS realtime worden gemonitord om de stimulatielocatie te bepalen (Dijkstra et al., 2025). Deze benadering maakt gebruik van de nauwe wisselwerking tussen hart en hersenen, die via het autonome zenuwstelsel voortdurend informatie uitwisselen. Door de individuele behandellocatie af te stemmen op de hartslagfluctuaties gedurende TMS, kan de effectiviteit van de stimulatie mogelijk worden vergroot, omdat dit zou samenhangen met netwerkactiviteit in de DLPFC en een netwerk dat is verbonden met het parasympatische zenuwstelsel. De eerste resultaten uit onderzoek suggereren dat deze gepersonaliseerde benadering mogelijk in de toekomst kan gaan bijdragen aan gerichtere en daarmee efficiëntere behandelingen.
Conclusie
TMS heeft zich in de afgelopen decennia ontwikkeld tot een waardevolle en effectieve behandelmethode binnen de geestelijke gezondheidszorg. Met name bij therapieresistente depressie is de werkzaamheid overtuigend aangetoond, maar ook bij andere psychiatrische aandoeningen zoals OCS en PTSS laat TMS veelbelovende resultaten zien. De behandeling is over het algemeen veilig, goed te verdragen en combineerbaar met andere behandelvormen. Dankzij technologische vooruitgang en voortschrijdend wetenschappelijk inzicht worden de behandelprotocollen steeds verfijnder en effectiever. Voor psychologen is het belangrijk om op de hoogte te zijn van de toepassingsmogelijkheden, indicaties en beperkingen van TMS, zodat zij deze behandeling op verantwoorde wijze kunnen inzetten.
